| Главная страница | Авторский информационный ресурс врача-исследователя Воробьева К.П. |
|---|---|
| Публикации | |
| Эта статья была впервые опубликована: | Клиническая информатика и телемедицина .-2011.- Том 7, вып 8.- с.132-152 |
РЕКОМЕНДАЦИИ ПО ПРЕДСТАВЛЕНИЮ РЕЗУЛЬТАТОВ КЛИНИЧЕСКИХ ИССЛЕДОВАНИЙ В ДИССЕРТАЦИЯХ И ЖУРНАЛЬНЫХ ПУБЛИКАЦИЯХ. ЧАСТЬ 2. ПРОЕКТ РЕКОМЕНДАЦИЙ
Recommendation about representation of results of clinical researches in dissertations and journal publications. A part 2. The project of references
K.P.Vorobyov
The state institution «Lagansk State medical university», chair of anesthesiology, resuscitation and urgent cases, Ukraine
Abstract
In the second part of the publication the project of the text of recommendation on representation of results of clinical researches in dissertations and journal publications is offered. Absence of the developed national traditions in this aspect of a clinical science demands attentive studying of the international experience. Ukraine essentially lags behind in use of reviewed magazines as most qualified and independent regulator of scientific activity. In the beginning references the brief information on the basic aspects of the most known international declarations and references in the field of the organization of clinical researches and the publication of their results is presented. In following sections, on the basis of the analysis of the international co-ordinated references, rules practice publication of rating scientific medical journals and current analytical publications the basic problems modern practice of publication are allocated and corresponding references are offered. Disturbance of the rights of the patient and the latent conflict of interests in clinical research are the main reasons of bias in clinical research. The problem of an estimation and the account of the intellectual contribution to research also are pressing question modern practice of publication. Therefore, the announcement of conflicts of interests and the author's contribution immediately in the publication is modern norm at the developed institute’s practice of publication. The choice and the correct formulation of design of clinical research is the qualifying characteristic of the researcher. On the basis of generalization of postulates clinical epidemiology references for choice type of design of clinical research are offered and prominent aspects are defined it most. In section of "Biostatistician" basic references on representation of results of the statistical analysis in clinical research are offered.
Keywords: format of the scientific publication, the reference, a clinical science, scientific misconduct.
Резюме
Во второй части публикации предложен проект текста рекомендаций по представлению результатов клинических исследований в диссертациях и журнальных публикациях. Отсутствие развитых национальных традиций в этом аспекте клинической науки требует внимательного изучения международного опыта. Украина существенно отстает в использовании рецензируемых журналов как наиболее квалифицированного и независимого регулятора научной деятельности. Вначале рекомендаций представлена краткая информация об основных аспектах наиболее известных международных деклараций и рекомендаций в области организации клинических исследований и публикации их результатов. В следующих разделах, на основе анализа международных согласованных рекомендаций, правил публикационной практики рейтинговых научных медицинских журналов и текущих аналитических публикаций выделены основные проблемы современной публикационной практики и предложены соответствующие рекомендации. Нарушение прав пациента и скрытый конфликт интересов в клиническом исследовании являются главными причинами систематических ошибок в клиническом исследовании. Проблема оценки и учета интеллектуального вклада в исследование также является актуальным вопросом современной публикационной практики. Поэтому объявление конфликтов интересов и авторского вклада непосредственно в публикации является современной нормой в развитых институтах публикационной практики. Выбор и правильная формулировка дизайна клинического исследования является квалификационной характеристикой исследователя. На основе обобщения постулатов клинической эпидемиологии предлагаются рекомендации по выбору типа дизайна клинического исследования и определяются его наиболее важные аспекты. В разделе «Биостатистика» предлагаются базисные рекомендации по представлению результатов статистического анализа в клиническом исследовании.
Ключевые слова: формат научной публикации, рекомендации, клиническая наука, недобросовестная практика научных исследований
Введение
В предыдущей части был представлен анализ проблемных вопросов современной международной клинической публикационной практики с позиций согласованных международных рекомендаций по подготовке отчетов о проведенных клинических исследованиях. Этот анализ демонстрирует существенное отставание национального украинского института клинических публикаций от общепринятой мировой практики. С учетом целого ряда обстоятельств обосновывается целесообразность создание современных национальных украинских рекомендаций по формату подготовки клинических отчетов в виде диссертаций и журнальных публикаций. В заключении предыдущей публикации предложена структура проекта будущих национальных рекомендаций [1].
Создание национальных рекомендаций по формату клинических публикаций требует совместной работы ряда экспертов и последующего широкого обсуждения. С другой стороны, следует помнить, что в Украине современные традиции клинической публикационной практики малоизвестны, а широкая научная общественность будет воспринимать новые рекомендации через призму существующих национальных традиций в клинической науке. Отсутствие государственной финансовой поддержки развития этого вопроса также препятствует созданию качественных национальных рекомендаций. Все эти обстоятельства необходимо учитывать соответствующим правительственным и общественным организациям, которые возьмут ответственность за формирование рекомендаций по формату представления клинических публикаций.
Цель: разработать проект национальных рекомендаций по формату подготовки клинических отчетов в диссертациях и журнальных публикациях.
ТЕКСТ ПРОЕКТА РЕКОМЕНДАЦИЙ
Вступление. Методология современных клинических исследований основывается на принципах клинической эпидемиологии – новой фундаментальной клинической науке, которая в течение последних двух десятилетий является одним из базовых образовательных предметов в медицинском образовании экономически развитых странах. Знания основных положений этой науки позволяет исследователям организовывать качественные клинические исследования и готовить соответствующие отчеты для рецензируемых журналов.
Современный врач также нуждается в знаниях принципов клинической эпидемиологии, так как только на основе этих знаний возможен отбор качественной клинической информации в огромном потоке журнальных публикаций. Знание врачом эпидемиологической терминологии также является необходимым условием для понимания современной клинической информации. Все эти знания являются основой для современной клинической практики с использованием технологий так называемой «доказательной медицины».
Украинская клиническая наука существенно отстает в использовании принципов клинической эпидемиологии в научных исследованиях, а клиническая эпидемиология до сих пор не является базовым образовательным предметом для исследователей и врачей. В сложившихся обстоятельствах необходимо активное самообучение и врачей и исследователей в области организации современных клинических исследований и в понимании современной клинической информации.
В экономически развитых странах существуют давние традиции унификации формата журнальной клинической публикации. В последние десятилетия работа национальных и международных организаций в этом направлении позволила создать согласованные рекомендации по формату клинических публикаций. Знание основных положений этих рекомендаций и международных традиций института журнальной клинической публикации, является важнейшим условием для развития национальной клинической науки и практики.
- 1. Этические и правовые вопросы клинического исследования
Современная клиническая наука все чаще затрагивает вопросы этики и права, требует соблюдения определенных стандартов при организации, проведении и подготовки отчетов о клинических исследованиях. Поэтому в течение последних десятилетий различные национальные и международные организации разрабатывают рекомендации по различным аспектам организации и представлению результатов клинических исследований в журнальных публикациях. В Украине подобные традиции отсутствуют, поэтому следует учесть существующий международный опыт в этом вопросе.
1.1. Современные международные рекомендации по формату биомедицинской публикации
Международный институт клинической публикации основывается на различных национальных и международных рекомендациях. Наиболее известные из них представлены в таблице.
Таблица 1.
Организации, декларации и рекомендации, которые лежат в основе современного института клинической публикации
Аббревиатура |
Оригинальное наименование организации/рекомендаций |
Источник |
|
английское |
русское |
||
|
Declaration of Helsinki |
Хельсинская декларация |
|
AMA |
American Medical Association |
Американская Медицинская Ассоциация |
|
CBE |
Council of Biology Editors |
Совет Биологических Редакторов |
|
CONSORT |
CONsolidated Standards Of Reporting Trials |
Единые стандарты представления результатов рандомизированных контролируемых испытаний |
|
COPE |
Council on Publication Ethics |
Совет публикационной этики |
|
CSE |
Council of Science Editors |
Совет Научных Редакторов |
|
EASE |
European Association of Science Editors |
Европейская Ассоциация Научных Редакторов |
|
EMWA |
European Medical Writers Association |
Европейская ассоциация медицинских авторов |
|
GCP |
Good Clinical Practice |
Стандарт надлежащей клинической практики |
|
GPP |
Good Publication Practice |
Pуководство по добросовестной публикационной практике |
|
HINARI |
Health InterNetwork Access to Research Initiative |
Инициатива обеспечения единой медицинской сети для исследований |
|
ICMJE |
International Committee of Medical Journal Editors |
Международный Комитет Редакторов Медицинских Журналов |
|
MOOSE |
The Meta-analysis Of Observational Studies in Epidemiology (MOOSE) Group |
Мета-анализ обсервационных исследований в эпидемиологии |
|
QUOROM |
Quality Of Reporting Of Meta-analysis |
Качество публикаций по результатам мета-анализа |
|
STARD |
Standards for Reporting of Diagnostic Accuracy |
Стандарты для отчетов Диагностической Точности |
|
STROBE |
Strengthening (первоначально STandards) the Reporting of OBservational studies in Epidemiology |
Укрепление (первоначально -стандартизация) отчетов о наблюдательных исследованиях в эпидемиологии |
|
WAME |
World Association of Medical Editors |
Всемирная ассоциация медицинских редакторов |
|
Основная задача данных рекомендаций – сформировать национальную модель клинической публикационной практики. Это можно сделать только путем тщательного анализа огромного интеллектуального пути, который уже прошли мировое научное сообщество. Поэтому в данном разделе рекомендаций представляется различные характеристики указанных в таблице деклараций и рекомендаций. Также предлагаются отдельные комментарии основных документов для их последующего самостоятельного изучения. Краткие сведения об истории каждого документа свидетельствуют о длительной и качественной эволюции международных традиций в данном вопросе. Ни один из документов не заменяет друг друга, но в целом они формируют представление о современном международном институте клинической публикационной практики.
Хельсинкская декларация. Эти рекомендации для врачей, проводящих медико-биологические исследования с участием людей, многократно пересмотрены Всемирной медицинской ассамблеей. Декларацию можно рассматривать как основной закон (конституцию) при организации кинических исследований. То есть все разрабатываемые рекомендации и стандарты должны строго соответствовать принципам Хельсинкской декларации. Восьмой пункт декларации дает прямые рекомендации по принципам публикационной практики: «При публикации результатов исследования врач обязан быть честным. Результаты исследований, проведенных не в соответствии с принципами настоящей Декларации, не должны публиковаться». Эта краткая рекомендация наряду с четкими и однозначными пунктами декларации о принципах организации и проведения клинических исследований лежит в основе всех перечисленных ниже документов.
Американская медицинская ассоциация (AMA). От имени этой организации и журнала «JAMA» в 2007 г. вышло десятое издание книги «Наставления по стилю: руководство для авторов и редакторов» [2]. Предыдущее девятое издание опубликовано в 1998 г., что свидетельствует об устоявшихся традициях в вопросах, изложенных в книге. В последнем издании обращается внимание на быстро меняющийся мир научной информации, на доминирование электронных средств предоставления и обмена информацией, на то, что авторы все чаще представляют журнальную публикацию через онлайновые системы и цитируют преимущественно информацию, находящуюся в сети Интернет (гл. 3.15, с. 63–72). В этом издании этические и юридические вопросы более объемны, чем в других рекомендациях, с акцентом на проблемах авторства (гл. 5), конфликте интересов, недобросовестной научной практике, проблемах интеллектуальной собственности и защите прав пациента. Руководство обращает внимание на растущее международное интеллектуальное медицинское сообщество и обсуждает известные стандарты публикационной практики.
Совет научных редакторов (СSE). Эта организация вначале возникла как Совет биологических редакторов (Council of Biology Editors — СВЕ) в 1957 г. благодаря объединенным усилиям Национального фонда науки и американского Института биологических наук, а с 1 января 2000 г. переименована в CSE, что более точно отражает ее расширение (насчитывает более 1200 членов). Основная миссия CSE состоит в оказании помощи ученым и авторам научных публикаций путем организации научной коммуникации и информационных научных сообществ, обучения, а также путем разработки авторитетных рекомендаций по вопросам организации научной информации. Под редакцией комитета СSE (2005-2006 гг.) подготовлена и свободно доступна в сети Интернет так называемая «Белая книга для продвижения целостности научных журнальных публикаций» [3]. 18 авторов этого руководства являются представителями врачебных ассоциаций и биомедицинских журналов. Две главы рекомендаций рассматривают исключительно этические проблемы журнальной публикации, в частности:
- описывают типы конфликтов интересов (личностный — финансовый — нефинансовый, прямой — непрямой),
- поддерживают критерии авторства ICMJE, но также существенно дополняют рассмотрение этой важнейшей этической проблемы (теневое, гостевое авторство и профессиональные авторы), предлагают журналам использовать специальные формы (контрольный список вопросов) для однозначного определения авторства в журнальной публикации;
- поддерживают регистрацию рандомизированных клинических испытаний (РКИ) до начала их проведения;
- особое внимание уделяют определению критериев недобросовестной научной практики (Research Misconduct), описывают формы и методы борьбы с этим явлением в различных странах;
- отдельный подраздел описывает способы защиты цифровой информации.
Характерным стилем вышеуказанного руководства является широкое использование перекрестных Интернет-ссылок на другие рекомендации, что позволяет получить наиболее полное представление об обсуждаемых проблемах.
Вторым известным руководством CSE является коммерческое издание «Научный стиль и формат», подготовкой которого занимается специальный подкомитет [4]. Это седьмое издание (первое опубликовано в 1960 г. организацией Council of Biology Editors — предшественником CSE). При его подготовке авторы учли широко известные аналоги форматов [5] и стилей научных публикаций [6]. Оглавление рекомендаций доступно в сети Интернет (http:// www.councilscienceeditors.org/publications/style_toc.cfm).
В соответствии с функциями CSE в этом издании расширено рассмотрение научных публикаций от медикобиологических к физическим. Большая часть руководства посвящена описанию достигнутых в научной литературе соглашений о сокращениях, аббревиатурах, правилах отображения специальными знаками различных физических параметров, принципах представления цитат и библиографических ссылок. Отдельная глава (№ 27) посвящена собственно стилю и формату журнальной публикации. Внимание уделено и методам отображения статистических характеристик результатов исследований. С учетом почти пятидесятилетней истории руководства можно сказать, что это базовые рекомендации по правилам терминологии, пунктуации и символизации в научной публикации.
Всемирная ассоциация медицинских редакторов (WAME) является добровольной ассоциацией представителей многих стран, которые стремятся способствовать международному сотрудничеству среди редакторов рецензируемых медицинских журналов. Членство в WAME свободно и открыто для всех редакторов рецензируемых медицинских журналов. WAME насчитывает более 1500 членов, которые представляют более чем 965 журналов из 91 страны (по данным на 18 июня 2007 г.).
Эта организация наиболее известна своими рекомендациями по принципам этики публикационной практики, которые доступны на сайте организации (WAME Publication Ethics Policies for Medical Journals; http://www.wame.org/resources/publication-ethics-policies-for-medical-journals#study) и в русскоязычном журнале [7].
В рекомендациях рассматриваются этические взаимоотношениям автор — редактор, проблемы авторства, процесс предварительного рассмотрения публикации, независимости редакторской политики. Также большое внимание уделяется недобросовестной исследовательской практике и анализу ее категорий. Особое внимание акцентируется на условиях возникновения конфликта интересов и редакторской политике в этих случаях.
WAME также известна своей принципиальностью в отстаивании независимости редакторской политики в разных журналах, что проявляется заявлением соответствующих протестов от имени ассоциации (http://www.wame.org/the-bellagio-report/wame-protests-forced-departure-of-nejm-editor, http://www. wame.org/the-bellagio-report/wame-protests-fring-of-jama-editor).
Европейская ассоциация научных редакторов (EASE) является интернационально ориентированным сообществом специалистов, всех тех, кто разделяет интерес к налаживанию коммуникаций в науке и редакционной деятельности (www.ease.org.uk). Одним из основных интеллектуальных и коммерческих продуктов этой организации является «Руководство для научных редакторов» [8] которое содержит структурированный сборник публикаций по основным проблемам редакторской деятельности.
Также эта организация выпускает журнал (European Science Editing), который анализирует предстоящие события, выпускаемые книги, программное обеспечение и акцентирует внимание читателей на актуальных публикациях. В этом журнале обсуждаются тонкости взаимоотношений между автором и редактором, состояние научной публикационной практики в различных странах, отдельные вопросы формата журнальной публикации. Такая и подобная информация помогает отечественным исследователям лучше понять реальные проблемы подготовки и продвижения журнальной публикации в авторитетных рецензируемых журналах. Очень важно, что через 6 месяцев после выпуска журнал доступен в электронной версии (http://www.ease.org.uk/esedown.html).
Европейская ассоциация медицинских авторов (EMWA) основана в 1989 г. как небольшая группа для обеспечения профессиональных биомедицинских коммуникаций между академическими, индустриальными и журналистскими объединениями. Его цель состоит в том, чтобы обеспечить дискуссию, внедрить стандарты качественных медицинских публикаций, содействовать профессиональному развитию исследователей и увеличивать понимание медицинских публикаций в Европе.
EMWA насчитывает более 550 участников из 24 стран (включая 7 стран вне Европы). На ежегодных весенних конференциях в городах Европы проводят обучение по базисным навыкам медицинской публикации, биостатистике, разработке документации и руководств для фармакоиндустрии, искусству представления научных данных. Ассоциация поддерживает содержательный сайт, на котором представлены соответствующие образовательные программы (http://www.emwa.org/index.html). На страницах журнала ассоциации «The Write Stuff» (http://www.emwa.org/Jornal.html) обсуждаются различные вопросы, в первую очередь проблемы авторства, взаимоотношений между объявленным и истинным авторством, вопросы обеспечения возможности доступа редакторов журналов к первичным данным исследования. Все эти вопросы систематизировано изложены в «Руководстве EMWA о роли медицинского автора в подготовке рецензируемой публикации» [9].
Инициатива обеспечения единой медицинской сети для исследований (HINARI). Это инициатива Всемирной организации здравоохранения (2002), в соответствии с которой сформирована единая сеть свободного или льготного доступа к периодическим изданиям. Для стран, чей валовой национальный доход на душу населения менее 1000 дол. США (к ним относится Украина), предоставляется бесплатный доступ к медицинской литературе в сети HINARI (http://www.who.int/hinari/en/). В 2004 г. инициативу поддержали 2800 журналов, более 60 издателей, а середине 2007 г. — 3750 журналов. Развитие этой инициативы не имеет прямого отношения к формату журнальной публикации, но обеспечение свободного доступа создает условия для открытой конкуренции медицинских журналов и увеличивает прозрачность процесса публикационной практики, что неизбежно положительно влияет на развитие формата журнальной публикации.
Единые стандарты представления результатов рандомизированных контролируемых испытаний (CONSORT). При оценке эффективности различных лекарственных средств РКИ считается наиболее адекватным дизайном клинического исследования. В начале 1990-х гг. две независимые группы разработали два варианта рекомендаций по составлению отчетов о РКИ. Затем усилия этих двух групп объединили и создали группу SORT (Standards of Reporting Trials), которую в дальнейшем назвали группой CONSORT. Эта группа включала исследователей-статистиков, эпидемиологов и редакторов биомедицинских журналов из различных стран. В 1996 г. вышел первый вариант CONSORT как стандарт представления результатов клинического исследования с дизайном РКИ.
По содержанию CONSORT — стандартизированный контрольный список для описания этапов РКИ и диаграмма хода процесса исследования. Контрольный список рекомендуемых подразделов содержит следующие пункты: название, абстракт, введение, методы, результаты и обсуждение. Последняя версия контрольного списка содержит 22 пункта. Диаграмма «тока» исследования позволяет отобразить особенности прохождение участников через РКИ.
Этот стандарт позволил улучшить качество сообщений о простом параллельном РКИ с двумя группами вмешательства, способствовал повышению прозрачности в отчетах о методах и результатах проведенных клинических исследований, легкости и точности их интерпретации.
Усилия группы CONSORT замечены медицинской общественностью. Редакционные коллективы многих журналов, включая «Lancet», «BMJ», «JAMA» и «Annals of Internal Medicine», различные объединения редакторов биомедицинских периодических изданий, в том числе Международный комитет редакторов медицинских журналов (Ванкуверская группа) и Совет редакторов научных журналов официально поддержали CONSORT. Стандарт CONSORT изложен в наиболее авторитетных медицинских журналах [10, 11; см. также http://www.biomedcentral.com/1471-2288/1/2], а на сайте организации доступен в переводе на русский язык (http://www.consort-statement.or-/index.aspx?o=1216). Группа известных ученых опубликовала разъяснения по использованию CONSORT [12], которые опубликованы также на русском языке [13]. Исходя из этих разъяснений следует, что:
- основная цель CONSORT заключается в том, чтобы облегчить критическую оценку и интерпретацию результатов РКИ за счет повышения качества публикаций, но при этом CONSORT нельзя рассматривать как инструмент для оценки методологического качества исследований;
- этот документ скорее направлен на повышение достоверности и обобщаемости (применимости) результатов проведенных исследований.
В недавнем исследовании на материале 1128 отчетов о РКИ за период 1996-2005 гг. установлено более высокое качество представления результатов исследований в тех журналах, которые поддерживают требования CONSORT при принятии публикаций [14].
Стандарт CONSORT рекомендован и для других (кроме РКИ) дизайнов клинических исследований. Однако для других типов исследований этот стандарт более интересен лишь как некий методологический принцип, который позволяет стандартизировать представление клинической информации в журнальной публикации. Поэтому появились инициативные группы по разработке стандартов представления отчетов по результатам других типов клинических исследований.
Качество публикаций по результатам метаанализа (QUOROM). Рекомендации предназначены для подготовки систематизированных обзоров по результатам РКИ. В разработке данных рекомендаций участвовали 30 международных экспертов (методологи, рецензенты и редакторы медицинских журналов), включая нескольких членов Кокрановского сотрудничества.
В результате разработаны контрольный список, состоящий из 21 вопроса, и блок-схема, которая предлагает автору обзора однозначно отобразить критерии включения/исключения в/из обзора. Такая схема позволяет снизить систематическую ошибку метаанализа из-за включения определенных обзоров в анализ. Рекомендации изданы в журнале «Lancet» в 1999 г. [15].
Стандарты для отчетов диагностической точности (STARD). Инициативная группа STARD, основываясь на методологии разработки CONSORT, 16-17 сентября 2000 г. на согласительной конференции проанализировала 33 варианта списков контрольных вопросов для диагностических исследований. Из этого списка отобрали 75 пунктов вопросов, которые в дальнейшем были редуцированы к единому списку из 25 вопросов. По аналогии со стандартом CONSORT также был разработан график потоков для описания диагностического исследования. В январе 2003 г. редакторы наиболее известных биомедицинских журналов приняли решение об одновременной публикации стандарта для отчетов по результатам диагностических исследований (Annals of Internal Medicine, British Medical Journal, Clinical Chemistry, Journal of Clinical Microbiology, The Lancet, Nederlands Tidschrift voor Geneeskunde, Radiology).
Отчет комитета группы STARD начинается следующей символичной фразой: «Мир диагностических тестов является очень динамичным» [16, p. 40]. Эта фраза обращает внимание на то, что в клинических исследованиях максимальные преобразования произошли в отношении принципов организации, проведения и оценки диагностических исследований. Согласно первому пункту контрольного списка STARD предлагается в наименовании, резюме и ключевых словах публикаций по результатам диагностических исследований использовать термины «чувствительность» и «специфичность», которые являются производными специального метода (изучение операционных характеристик диагностического теста). За этими терминами стоят однозначные цифровые характеристики диагностического теста, которые читатель крайне редко встретит в отечественных исследованиях, даже в докторских диссертациях.
Укрепление отчетов о наблюдательных исследованиях в эпидемиологии (STROBE). Это еще одна международная инициатива, которая основана на методологии CONSORT. В 2003 г. группа эпидемиологов, методологов, статистиков, исследователей и редакторов, участвующих в проведении и распространении наблюдательных исследований, наметила общие контуры данной инициативы и разработала план мероприятий первого семинара, проведенного на кафедре социальной медицины университета Бристоля (Великобритания) в сентябре 2004 г. Этот семинар финансировался Европейским фондом науки. В семинаре приняли участие 23 человека, в том числе редакторы наиболее авторитетных клинических журналов. Было проведено пленарное заседание и три секционных, в которых рассматривались дизайны трех типов обсервационных исследований: когортных, случай — контроль и поперечных исследований. Для каждого из этих дизайнов идентифицированы ключевые пункты (item) с дальнейшим составлением контрольного списка (checklist) и попыткой найти общие для этих трех дизайнов ключевые пункты. На основе рекомендаций CONSORT для пролонгированных и объяснительных исследований (extensions and explanations, E&E) предложены примеры качественных отчетов. В ноябре 2004 г. среди участников семинара и заинтересованных лиц был распространен первый вариант контрольного списка. Дополнительные комментарии (сентябрь 2005 г.) позволили создать третью версию такого списка, который включает 22 пункта с некоторыми различиями для каждого из трех вышеперечисленных типов обсервационных исследований (STrengthening the Reporting of OBservational studies in Epidemiology: Checklist of essentialitems. Version 3 (Sept. 2005); http://www.strobe-state-ment.org/Checklist.html).
Характерно, что в первоначальном варианте первая буква аббревиатуры «STROBE» происходила от слова Standards (стандарты), но позже первое слово в наименовании изменили на STrengthening (укрепление), что отражает рекомендательный характер соответствующего документа.
Столь быстрое развитие инициативы STROBE, возможно, связано с осознанием медицинским клиническим сообществом ограничений исследований с дизайном РКИ. Обсервационные исследования могут быть отнесены к исследованиям текущей клинической практики без вмешательства. Это означает большую свободу выбора для исследователя за счет низкой стоимости таких исследований и фактического отсутствия этических ограничений.
Метаанализ обсервационных исследований в эпидемиологии (MOOSE). Интерес к обсервационному дизайну клинических исследований у широкого круга международной клинической общественности также подтверждается возникновением инициативной группы MOOSE. В апреле 1997 г. в Атланте проведен семинар с целью разработки рекомендаций для подготовки систематизированных обзоров обсервационных клинических исследований. На семинаре был сформирован комитет MOOSE, который включал 27 специалистов по экспертизе в клинической практике, испытаниям, статистике, эпидемиологии, общественным наукам и биомедицинскому редактированию. Эта группа на основании изучения литературы за последние 50 лет разработала и опубликовала соответствующие рекомендации [17].
Основным результатом работы группы явился контрольный список вопросов, необходимых при подготовке метаанализа обсервационного клинического исследования. Основные рекомендации MOOSE направлены на минимизацию источников систематических ошибок в анализируемых обсервационных исследованиях, в том числе с учетом источников финансирования соответствующих обзоров.
Стандарт надлежащей клинической практики (GCP) представляет собой алгоритм планирования и организации РКИ, а также подготовки соответствующего отчета. Основной целью GCP является увеличение достоверности результатов РКИ при соблюдении гарантий безопасности испытуемых, охраны их прав и здоровья в соответствии с принципами Хельсинкской декларации и национальными традициями. Стандарт GCP разрабатывался при участии представителей стран Европейского сообщества, Японии и Соединенных Штатов Америки [18]. Основная направленность данного стандарта — испытание эффективности лекарственных средств (http://www.ich.org/LOB/media/MEDIA482.pdf). В рекомендациях также указывается, что «принципы данного руководства могут быть распространены на другие клинические исследования, при проведении которых нельзя исключить нежелательное влияние на безопасность и благополучие человека». По своей структуре GCP является классическим документом с точки зрения понятия «стандарт», определяет используемую терминологию, содержит четкие указания последовательности этапов проведения клинического испытания, представляет рекомендации по подготовке брошюры исследователя, протокола клинического испытания и выходных документов проведенного РКИ. Стандарт GCP прямо не затрагивает вопросы подготовки журнальной публикации, но является ценным методическим пособием при подготовке раздела «Материалы и методы КИ».
Руководство по добросовестной публикационной практике (GPP). Это руководство можно считать прямым продолжением инициативы GCP. Руководство разработано по инициативе, для и при участии фармацевтических компаний [19]. Это достаточно краткий документ, который поддерживает основные международные рекомендации публикационной практики (ICMJE, CONSORT) и сосредотачивает внимание на вопросах взаимоотношений между представителями фармацевтических компаний и исследователями, преждевременных и дублирующих публикаций, а также на роли профессиональных авторов и их авторском вкладе в журнальную публикацию.
Международный комитет редакторов медицинских журналов (ICMJE). Эта международная организация разработала и поддерживает развитие «Единых требований к рукописям, представляемым в биомедицинские журналы: правила написания и редактирования материалов». История создания и развития единых требований насчитывает более 30 лет. Вначале редакторы нескольких ведущих медицинских журналов на неофициальной встрече в Ванкувере приняли решение о необходимости разработки такого документа. В 1979 г. первая редакция единых требований предлагала лишь формат библиографических ссылок. Позже к этой инициативе присоединились другие редакторы биомедицинских журналов и эта так называемая Ванкуверская группа была преобразована в ICMJE, которая проводит ежегодные совещания и периодически вносит изменения в единых требованиях.
Рекомендации предназначены для авторов и редакторов биомедицинских журналов для облегчения создания и рецензирования ясных и точных отчетов о результатах клинических исследований. Если первые редакции единых требований были направлены на создание единообразной структуры журнальной публикации с использованием единых правил цитирования и подготовки библиографии, то последующие редакции единых требований сосредоточили внимание на таких этических вопросах, как авторство, редакционная свобода, конфликт интересов, защита прав пациентов, взаимоотношения автора и редактора. В единых требованиях также достаточно подробно описывается структура типовой биомедицинской журнальной публикации с указанием некоторых требований к каждому разделу журнальной публикации.
Эти рекомендации находятся в открытом доступе в сети Интернет (www.icmje.org). На сайте ICMJE доступна последняя редакция единых требований.
В целом следует заметить, что единые требования представляют собой наиболее полные, всесторонние рекомендации по всем этапам взаимодействия с редактором и по формату журнальной публикации. Несмотря на то, что единые требования во всем мире признаны стандартом качества публикационной практики, в Украине ни один из биомедицинских журналов до сих пор не принял в полной мере эти рекомендации.
1.2. Соблюдение прав пациента в клинических исследованиях
Вопросы соблюдения прав пациента в клинических исследованиях определяет Хельсинкская декларация (см. выше). Одно из основных положений этой декларации гласит, что: «В любом исследовании на людях каждый потенциальный испытуемый должен быть достаточно информирован о целях, методах, ожидаемых выгодах и потенциальном риске исследования, а также о неудобствах, которые оно может повлечь за собой … Врач должен получить у испытуемого добровольное согласие на основе полной информации, предпочтительно в письменном виде».
Другим важнейшим условием соблюдение прав пациента в исследовании является разделение роли исследователя и врача. Задачей лечащего врача является защита пациента от возможных негативных последствий исследования и применение по отношению к пациенту лучших лечебных и диагностических средств. С научной точки зрения врач должен быть уверен в высокой вероятности так называемой нулевой гипотезы о том, что изучаемый и сравниваемый методы являются сопоставимыми по эффективности и безопасности. В реальности – это условие достаточно сложно выполнить, но именно этот вопрос должен быть в центре этических комитетов.
Уровень рисков для пациента определяется дизайном планируемого клинического исследования. В исследованиях с дизайном РКИ наиболее вероятны нарушения прав пациента. В обсервационных клинических исследованиях без вмешательства в лечебный процесс риски для пациента в связи с проводимым исследованием являются минимальными. Контроль соблюдения прав пациента осуществляют этические комитеты различного уровня, которые обязаны рассмотреть и утвердить протоколы будущих клинических исследований.
1.3. Конфликт интересов в клиническом исследовании
Конфликт интересов (конкурирующие интересы) в клиническом исследовании является достаточно новой и малоизвестной темой для отечественного исследователя. Тем не менее, все современные рекомендации по этике научных публикаций уделяют пристальное внимание этой проблеме и требуют явного раскрытия различных типов конфликтов интересов на страницах журнальных публикаций и в других информационных источниках.
Пристальное внимание к теме конфликтов интересов обусловлено тем, что конфликт интересов является основной причиной так называемых «систематических ошибок исследования», которые смещают результат исследования в ту или иную сторону, в зависимости от мотиваций участников исследования. Конфликт интересов, таким образом, является главной причиной недобросовестной практики научных исследований (см. следующий раздел).
В базовых рекомендациях для биомедицинской публикационной практики «Единые требования к рукописям, представляемым в биомедицинские журналы: правила написания и редактирования материалов», в разделе II. D. «Conflicts of Interest» указывается на прямую взаимосвязь доверия к публикации с одной стороны и степени раскрытия конфликтов интересов со стороны автора, рецензента и редактора.
Чаще всего конфликт интересов может быть связан с финансовыми отношениями участников исследования и авторов публикации. Финансовые отношения опознаются легче остальных, но существуют и другие факторы конфликтов интересов, которые основываются на академическом соревновании, интеллектуальной страсти (intellectual passion) или личных отношениях иного рода. Авторы и все участники принятия редакторского решения обязаны раскрыть все взаимоотношения, которые могли бы быть рассмотрены как конфликт интересов. Рекомендации обращают внимание, что раскрытие таких отношений также актуально по отношению к передовым и обзорным статьям. Чтобы предотвратить двусмысленность, авторы должны заявить во всеуслышание, имеются ли потенциальные конфликты или их не существует. Рекомендуется сделать это в рукописи на первой странице публикации.
В некоторых случаях редакции журналов предлагает автору предоставить редакторам имена людей, которые могут иметь по отношению к авторам скрытый конфликт интересов. С другой стороны, рецензенты должны раскрыть редакторам любые конфликты интересов, которые могли бы оказать влияние на их мнение относительно рукописи, и в таких случаях они должны самоустраниться от рассмотрения определенных рукописей. Молчание со стороны рецензента может, напротив, подтверждать существование конфликта интересов. Поэтому следует просить рецензентов явно обозначить наличие или отсутствие конфликта интересов. Редакторы должны регулярно на сайте журнала обновлять информацию о потенциальных конфликтах интересов, связанных со штатом журнала.
Рекомендации WAME по принципам этики журнальных публикаций в разделе «Конфликты интересов» обращают внимание на такую категорию как возникновение «желание оправдываться» после случайного раскрытия конфликта интересов в уже выполненной и опубликованной работе и говорят об источнике конфликтов интересов при возникновении любого доверительного интереса ко всему, что связано с предметом исследования [7].
Международная научная общественность уделяет особое внимание обеспечению редакторской свободы. Все основные международные рекомендации отстаивают принцип свободы принятия редакторских решений. Более того, рекомендации WAME предполагают вмешательство общественности в решения владельца журнала при найме и увольнении главного редактора: «Кроме того, предпочтительно, чтобы любая оценка, на которой основывается найм или увольнение, проводилась группой независимых экспертов, а не небольшим числом людей, близких к владельцу журнала». Рекомендации WAME настоятельно предлагают раскрывать конфликты интересов «редактор — владелец журнала» на сайтах и страницах журналов. Международная научная общественность тщательно охраняет право редактора медицинского журнала определять долговременные стратегии развития журнала. В случаях ограничений редакторской свободы WAME активно защищает это право, что, безусловно, подрывает авторитет журналов и, в конце концов, снижает прибыль владельца журнала. Примеры нескольких протестов против ограничения редакторской свободы опубликованы на сайте WAME (http://www.wame.org/the-bellagio-report/wame-protests-firing-of-ja-ma-editor, http://www.wame.org/the-bella-gio-report/wame-protests-forced-depar-ture-of-nejm-editor, http://www.wame.org/the-bellagio-report/wame-board-letter-on-behalf-of-the-i-croatian-medical-journal-i).
Такая практика в нашей национальной модели клинической публикационной практики кажется невыполнимой, по одной простой причине – в Украине пока отсутствуют нормальные формы самоорганизации врачей и исследователей. С другой стороны, в настоящее время наступает этап, который будет характеризоваться нарастанием конкуренции журналов и борьбой за их авторитет в научном сообществе. Без обеспечения редакторской свободы невозможно создать авторитетный научный журнал.
В феврале 2005 г. рабочая группа CSE разработала и выложила на своем сайте в свободном доступе достаточно подробные рекомендации по формам объявления конфликта интересов в журнальных публикациях. В этом материале не только приведены обширные списки возможных вопросов для раскрытия конфликта интересов, но также предлагаются ссылки на уже действующие опросные листы в других журналах (http://www.councilscienceeditors.org/events/retreat_paper_2005-02.pdf).
Основная цель раскрытия конфликта интересов — это не влияние на решение о публикации статьи, а предоставление информации читателю, чтобы он вынес собственные суждения о степени влияния конфликта интересов на содержание публикации. Предлагается перечислять взаимоотношения с корпорациями, которые выпускают определенный продукт или оказывают услуги, связанные с предметом статьи. Такие отношения включают работу, владение акциями, постоянное или эпизодическое консультирование, участие в работе совета директоров или в общественной ассоциации, имеющих отношение к обсуждаемому продукту или компании. Также источником конфликта интересов является получение гонораров за консультирование, доклады на конференциях, оказание услуг в обмен на гонорары (PNAS Conflict of Interest Policy, http://www.pnas.org/site/misc/coi.shtml). Эти рекомендации дополняются специальным опросным листом по темам возможных конфликтов интересов с разъяснениями каждого пункта (National Science Foundation, Arlington, VA 22230, Conflict-of-Interests and Confidentiality Statement for NSF Panelists, http://www.nsf.gov/pubs/2002/ form1230p/form1230p.pdf).
Редактор известного и авторитетного электронного медицинского журнала «The PLoS Medicine» так обозначает современное понимание конфликта интересов в публикационной практике: «Нефинансовые конкурирующие интересы (иногда так называемые частные интересы) могут быть личными, политическими, академическими, идеологическими или религиозными»[20]. Политика этого журнала требует, чтобы редакторы самоустранялись от обсуждения редакторского решения по определенным публикациям, которые создаются друзьями, коллегами или противниками (http://www.plosmedicine.org/article/info:doi/10.1371/journal.pmed.0020088). На сайте этого журнала представлены замечательные образцы политики журнала в области раскрытия конфликта интересов (Competing Interests Policy, http://journals.plos.org/plosmedicine/competing.php) и раскрытия конфликтов интересов редакторской группы (Competing Interests of the PLoS Medicine Editors, http://journals.plos.org/plosmedicine/editors_interests.php).
Одной из причин конфликта интересов является цеховость врачебных сообществ и сложные взаимоотношения при рецензировании работ «из другого цеха» [21]. Также существует не только предвзятое отрицательное отношение рецензента к определенным авторам и их работам, но и противоположная ситуация, когда рецензенты, благосклонно относящиеся к некоторым авторам, с большей вероятностью рекомендуют принять публикацию к печати [22].
Один из образцов описания конфликта интересов представлен на сайте COPE в разделе представления председателя этой организации Elizabeth Wager, которая совмещает свою деятельность с выполнениями функций медицинского писателя для фармацевтических компаний и членством в различных организациях, развивающих современный формат клинической журнальной публикации (http://publicatio-nethics.org/about/council/elizabeth-wager).
Тема конфликта интересом в нашем национальном клиническом сообществе тесно переплетается с установившимися общественными нравами, которые являются основой коррупции в стране. Формирование практики объявления конфликта столкнется с серьезным сопротивлением со стороны различных участников клинических исследований и публикаций: производителей медицинских средств, авторов, научной элиты. Решение этих вопросов потребует законодательных решений и проявления политической воли со стороны различных ветвей власти. Но без решения этих вопросов невозможно рассчитывать на дальнейшее развитие национальной клинической науки.
1.4. Недобросовестная практика научных исследований
Совет научных редакторов в своих рекомендациях (Council of Science Editors, 2006) определяет, что: «термин «недобросовестная научная практика» относится к любому действию, которое связано с неправильным обращением с предметом исследования или с целенаправленной манипуляцией научным отчетом таким образом, что он больше не отражает наблюдаемые явления». По мнению рабочей группы CSE, в ряду серьезных форм (a serious form) недобросовестной практики научных исследований на первом месте находится неэтичное обращение с предметами исследования и только затем — общепринятые категории недобросовестной практики научных исследований: фабрикация, фальсификация данных и плагиат.
Наиболее полно правила этики научных публикаций представляет Британский комитет по этике научных публикаций (COPE). В рекомендациях по добросовестной практике научных публикаций рабочая группа COPЕ обращает внимание на следующие вопросы: соответствие дизайна (структуры) исследования его целям, правильный выбор методов анализа данных, учет и объявление возможных случайных и систематических ошибок, соблюдение международных норм авторства и ответственность авторов за целостность публикации, объявление различных типов конфликтов интересов, недопущение дублирующих публикаций, плагиат, выполнение этических обязательств редакторов и рецензентов. Соблюдение всех этих этических норм при подаче научной публикации в редакцию может быть подвергнуто формальной проверке и, по сути, эти вопросы относятся к методологическим аспектам научного исследования. То есть, авторитетная международная организация, таким образом, показывает, что низкая квалификация ученого не соответствует нормам этики в науке. Доказательство фактов фабрикации и фальсификации данных требует специального расследования и не в полной мере входит в компетенцию редактора журнала.
1.4.1. Фальсификация данных клинических исследований
Всемирная ассоциация медицинских редакторов (WAME) в рекомендациях по принципам этики публикационной практики [7, http://www.wame.org/] при перечислении явлений недобросовестной научной практики так классифицирует проблему фальсификации данных клинического исследования:
- фальсификация данных, которая варьирует от подделки результатов до вводящего в заблуждение избирательного опубликования и отказа от обнародования противоречивых данных или преднамеренное утаивание и/или искажение данных;
- несоответствующее выполнение экспериментов с целью получения смещенных результатов, вводящие в заблуждение статистические или аналитические манипуляции или неточное сообщение результатов;
- преднамеренное искажение характеристик, событий или результатов исследования с целью ускорения продвижения исследовательской программы, получения финансовой поддержки или профессионального продвижения.
Фабрикацию и фальсификацию данных клинического исследования трудно выявить на этапе представления научной публикации в журнал. Одним из наиболее действенных механизмов борьбы с этим явлением является определенный протокол ведения первичной документации исследования и обеспечение доступа рецензентов и оппонентов к первичному материалу исследования по требованию (см. ниже).
1.4.2. Плагиат
Одним из самых тяжелых проступков ученого является плагиат. Рекомендации WAME дают наиболее исчерпывающие разъяснения этой проблемы: «Плагиат — это использование чужих опубликованных или неопубликованных идей или слов (или другой интеллектуальной собственности) без указания авторства или разрешение и представление их как новых и оригинальных, а не как полученных из существующих источников... Этот термин применяется вне зависимости от того, взяты эти идеи или слова из рефератов, заявок на получение исследовательских грантов, заявок в этический контрольный комитет, материалов, опубликованных в любом виде (печатном или электронном) или неопубликованных». При оценке самоплагиата, то есть о цитировании автором самого себя без соответствующих ссылок «не существует единого мнения, относится ли эта форма к недобросовестной практике научных публикаций» [7]. Особая форма плагиата существует при нарушении авторских прав. В этом случае тот, кто не имеет отношения к интеллектуальному продукту, может быть обвинен в плагиате. Особенно это касается почетных авторов, которые подписываются под публикацией теневого автора.
Плагиат наиболее распространен в научном сообществе и, вместе с тем, его легче всего формализовать. Каждый настоящий ученый тщательно оберегает свою интеллектуальную собственность, а борьба с плагиатом — способ самоочищения науки. Заимствование чужой собственности без разрешения собственника более верно называть воровством. В недавней рейтинговой публикации сотрудников ORI первый пункт рекомендаций в защиту целостности научных исследований звучит следующим образом: «необходимо создать климат нулевой терпимости к явлениям недобросовестной практики научных исследований». Так как плагиат относится к тяжким формам научных преступлений — «a serious form of misconduct» [3], то интеллектуальное воровство должно быть предметом пристального внимания научного сообщества.
1.5. Правила предоставления доступа к первичному материалу исследования
Для расследования тяжких нарушений (фальсификация, фабрикация, плагиат) необходимы факты в виде наличия или отсутствия у автора публикации первичной информации исследования. Во введении рекомендаций WAME однозначно определена возможность доступа редактора журнала к первичным данным исследования: «Данные и отчеты должны быть сохранены и доступны для ознакомления по запросу». В рекомендациях по этике публикаций COPE предлагается «сохранение данных на длительный (до 15 лет) срок; эта обязанность обычно возлагается на главного исследователя». В Германии этические рекомендации предлагают сохранять первичные данные в течение 10 лет. Причем отказ автора сотрудничать в расследовании рассматривается как подтверждение виновности исследователя [23]. Таким же образом к отказу от сотрудничества относится стандарт ORI [24].
При подозрении на фабрикацию или фальсификацию первичных данных исследования редактор, в соответствии с этическими нормами и правилами журнала, вправе запросить первичные данные и другие официальные документы, которые подтверждают факт проведения исследования и связь вторичных данных, приведенных в статье, с первичными данными результатов исследования. Это право редактора закрепляется подписанным одним из авторов (обычно ответственный автор) утверждением о том, что он имеет доступ ко всем данным исследования. При получении первичных данных редактор может сделать собственные выводы о факте фабрикации или фальсификации результатов исследования и выработать редакторское решение по пресечению или расследованию случая недобросовестной практик научных исследований. Следует отметить, что даже отзыв автором публикации в таком случае требует окончания расследования [7]. Предполагается, что о результатах редакторского расследования будут сообщено в учреждение, где проводилось исследование и в правительственную контролирующую организацию.
1.6. Авторство
1.6.1. Определение терминов.
Почетное, или подарочное авторство (Honorary or gift authorship) основывается на незначительном участии в исследовании. Типичным примером является "авторство", основанное на таком положении, как руководитель ведомства, в котором имело место исследование [25, p.18].
Гостевое авторство (Guest authorship) основывается на ожидании, что включение определенного имени улучшит возможности того, что исследование будет издано или увеличит оценку статуса публикации. Гостевой автор не делает заметного вклада в указанное исследование и поэтому не соответствует ни одному из критериев для авторства [25, p.18].
Призрачное авторство (ghost authorship) определено как отказ раскрыть вклад в соответствии с критериями ICMJE для авторства. Типичный пример призрачного авторства - нераскрытые вклады медицинских авторов в проект рукописи [25, p.18].
Раскрытие (disclousere) выполнение требования конкретного журнала в отношении декларации новизны содержания, фактического вклада автора в исследование и написание статьи, раскрытие финансового и конфликта интересов [25, p.18].
Вклад автора (contributorship) некоторые журналы используют форму декларации вклада автора в исследование. Авторы могут ожидать, что эти вклады редакторы издадут вместе с рукописью [25, p.19].
Раскрытие финансового и конфликта интересов. Многие журналы требуют, чтобы авторы обнародовали источники финансирования исследования (правительственного, корпоративного и другого), предоставления любых продуктов иди услуг (материалы, оборудование, статистический анализ и написание статей) - все, что предоставляется третьими лицами в ходе выполнения исследования и отчета о результатах (написание публикации, статистический анализ). Некоторые журналы предусматривают раскрытие авторами финансовых отношений в суммах и устанавливают определенные долларовые пороги. Пункты, которые будут раскрыты включают оплачиваемую работу, консультирование, владение собственностью, гонорары, участие в экспертизе и другое [25, p.19]. Этот пункт имеет особую взаимосвязь с гостевым и призрачным авторством.
Порядок авторов (order of authorship) – порядок имен в списке авторов или исследовательских групп. Авторы не должны рассчитывать на то, что редакторы будут вовлечены в споры о порядке авторов. Некоторые журналы определяют, сколько авторов они укажут в авторском списке.
Анонимное авторство. В редких случаях редакторы журналов могут издать анонимный текст. Такую практику лучше не использовать, но это может быть необходимым, если публикация будет угрожать автору (угроза личной безопасности или потеря работы). Псевдонимы приемлемы в публикациях, которые носят характер беллетристики. В этих случаях редактор также обязан обладать информацией об авторских правах и получить соответствующие раскрытия.
Благодарности (acknowledgments). Ожидается, что авторы предоставят список персон, вклад которых в исследование не квалифицируется, как авторский вклад. Эти персоны должны подписать форму раскрытия, по крайней мере, они должны быть осведомлены о том, что их имена появятся в соответствующем разделе публикации.
Старший автор, или гарант определяется как автор, который ведет исследование и делает главный вклад в работу. На этого автора возлагается также функция гаранта целостности работы и подтверждение того, что ему доступны все первичные данные исследования. Все авторы в начале проекта должны установить старшее авторство, предпочтительно в письменном соглашении (Michigan Medical School, http://www.msu.edu/~biomed/rcr/authorship.htm).
Ответственный автор (corresponding author) иногда выполняет функции старшего автора, но чаще на этого автора просто возлагается функция взаимосвязи с редакцией журнала. В некоторых журналах предполагается, что ответственный автор должен также предоставить определенную информацию о вкладах всех соавторов в публикацию [26].
В клинической науке наиболее распространены проблемы теневого, гостевого авторства и оценки интеллектуального вклада каждого автора в исследование
1.6.2. Гостевое и подарочное авторство
Гостевое авторство является общей проблемой мирового научного сообщества, является достаточно распространенным и с точки зрения главного редактора BMJ отражает двойную мораль в этом вопросе, в том числе и со стороны главных редакторов журналов [27].
На понимание проблемы гостевого авторства в научных публикациях откладывает отпечаток национальные традиции и нравы в социуме. Авторство во многих случаях является политическим решением, определяется положением соавтора в лестнице иерархии. Не у многих младших исследователей есть храбрость, чтобы отказаться от вежливых неявных или явных требований включить определенное лицо в соавторы, даже если вклад этих лиц в работу был незначителен. Иногда старших исследователей включают в соавторы и ставят на первое место, чтобы увеличить вероятность принятия статьи. Тот, кто сделал научную работу обычно, делает подарок соавторства с некоторым скрытым мотивом - продолжения работы, поощрения в работе, для поддержания дружбы и т.д. Один из исследователей этой проблемы заявляет: «Подарочное авторство - взятка, заплаченная реальным научным работником, потому что он ожидает кое-что взамен. Принятие этого подарка – обязательство, которое позволяет получить что-то взамен… Как только один сотрудник устанавливает эту тенденцию, другие обязаны следовать за ним» [28].
Еще один исследователь считает, что читатели знакомы с распространенным злоупотреблениями авторством. Например, с такими ситуациями когда: университетский руководитель настаивает на включении своего имени в каждую публикацию; аспиранту предлагают написать обзор или публикацию, а затем лишают его авторства, предлагают соавторство работникам других подразделений (особенно клинических отделов) для того, чтобы в дальнейшем старшие члены этих подразделений получающие соавторство разрешили использование оборудования, пациентов и лабораторий для исследований. Из всего этого следует, что гостевое авторство является устоявшейся традицией, которую трудно уничтожить [29].
1.6.3. Призрачное или теневое авторство
По оценкам Richard Smith бывшего главного редактора BMJ до трех четвертей исследований финансируются фармакокомпаниями [30]. Одним из наиболее распространенных приемов продвижения на рынок лекарств является подготовка статей профессиональными медицинскими писателями (призрачные теневые авторы) и приглашение за материальное вознаграждение гостевого автора возглавить список авторов этой публикации. В недавнем исследовании (2007) северного Кокрановского центра на материале 44 научных публикаций по результатам рандомизированных клинических испытаний за 1994-1995 годы определили, что в 75% случаев практикуется призрачное авторство (95%-ый доверительный интервал 60% - 87%). Квалификация публикаций с призрачным авторством увеличивалась до 91% (95%-ый доверительный интервал 78%-98%), если учитывалась часть реальных авторов, которые были перемещены из списка авторов в раздел "Благодарности" [31].
В достаточно подробном обзоре Sergio Sismondo (2008) показаны масштабы и механизмы призрачного авторства [32]. По данным целого ряда исследователей призрачное авторство является скорее обычной практикой, чем исключением. Фармацевтические компании отрабатывают специальные технологии вовлечения известных ученых в качестве авторов тех публикаций, которые ориентированы на определенный результат выгодный производителям лекарственных средств. Что еще более интересно, крупные производители лекарственных средств формируют рынок теневых и гостевых авторов. Например, с высокой вероятностью можно утверждать, что рынок теневых авторов формируется через такие организации, как The International Publication Planning Association (TIPPA, http://www.publicationplanningassociation.org/about.aspx), International Society for Medical Publication Professionals (SMPP, http://www.ismpp.org/), The Center for Business Intelligence (CBI, http://www.cbinet.com/).
Пренебрежение критериями авторства позволяет успешно манипулировать мнением общественности. В рамках исследований конкретных препаратов доказаны многочисленные факты призрачного авторства. В 2003 году Healy D. и Cattell D. показали, что многие из 85 публикаций по проблеме препарата Sertraline (Pfizer) были написаны профессиональными авторами, представляющими интересы производителя, что нарушает авторские стандарты. При анализе 250 публикаций, которые были связаны с новым препаратом рофекоксиб (Merck) было определено, что публикации по результатам клинических испытаний рофекоксиба были созданы служащими спонсора, но затем первое авторство присваивалось академическим исследователям, которые не всегда раскрывали финансовую поддержку [33].
1.6.4. Интеллектуальный вклад в клиническое исследование
Представленные выше примеры нарушения авторского вклада в исследование нарушает целостность научного исследования, что существенно замедляет развитие науки за счет снижение конкурентных условий и, по сути, является коррупцией. Поэтому в последнее десятилетие согласованные международные и национальные рекомендации уделяют особое внимание проблеме авторского вклада в исследование.
В требованиях ICMJE сказано, о том, что «Редакторам рекомендуется строго придерживаться политики формализации авторского вклада и публиковать информацию о том вкладе, который внес каждый участник, обозначенный как автор». Рекомендации этой международной организации по проблеме указания авторского вклада можно представить следующей схемой (рис.1).
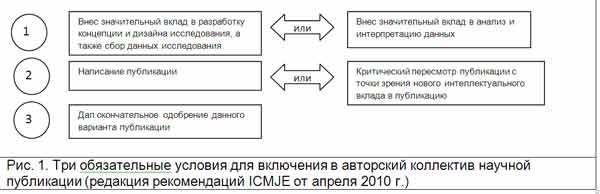
Существует целая серия публикаций, в которых предпринимается попытка систематизировать и выделить приоритеты авторского вклада [34-36]. Также предлагается новый подход, при котором читателям будет предлагаться не список авторов, а список вкладчиков в исследование с определенными категориями вкладов [37].
Различные системы оценки авторского вклада характеризуются противоречивостью, которая состоит в том, что иногда приоритет отдается некоторым вкладам в исследование, которые действительно могут иметь важнейшее значение, но, тем не менее, не могут быть охарактеризованы как интеллектуальный вклад. Например, если рекомендации ICMJE исключают из авторства нетворческое участие в исследовании, то рекомендации GPP (созданы фармакокомпаниями и для фармакокомпаний) допускается включение в авторский коллектив тех кто только «выполнял сбор данных и другую механическую работу». Такая работа как подбор источников информации для обзора литературы, систематизация первичного материала, сбор данных исследования, статистическая обработка результатов исследования и прочая деятельность может происходить без всяких элементов творческого процесса, в рамках простого использования специальных знаний. При этом не важно получает за эту работу специалист заработную плату, или выполняет эту работу по собственной инициативе, важно, что он не участвует непосредственно в создании нового знания, а лишь подготавливает материал для анализа кому то (истинному исследователю), кто может в этой информации обнаружить новые закономерности и вывести формулу нового знания.
По этим причинам необходима классификация авторского вклада, основанная на главной классификационной категории авторского вклада – интеллектуальный вклад в исследование. Это ключевое понятие используется буквально во всех рекомендациях, которые посвящены проблеме авторства в научных публикациях. Модель процесса, являясь концентрацией системного знания об изучаемом объекте, является высшей интеллектуальной ценностью в науке и представляет собой не что иное, как новое знание, то есть то, что является целью науки. Исходя из этого приоритета и на основе анализа литературы, можно следующим образом классифицировать иерархию ценностей интеллектуальных вкладов в научную клиническую публикацию (табл. 2).
Таблица 2
Иерархия интеллектуальных вкладов в исследование
Формулировка вклада в исследование |
Сущность определенной категории вклада в исследование |
Характеристики автора - предпосылки для реализации определенной категории вклада в исследование |
Идея исследования |
Обнаружение и формулировка конфликта текущей парадигмы и новых фактов |
Знание парадигмы, наблюдательность, интуиция, умение выделить из текущей практики новые явления |
Научная гипотеза |
Объяснение новых фактов в контексте собственной теории процесса/явления |
Знания теории процесса/явления, широта научных взглядов, способность анализировать и обобщать |
Дизайн исследования |
Разработка оригинального плана наблюдательного или экспериментального исследования для наиболее эффективной проверки новой гипотезы |
Знание методологии клинического исследования (клиническая эпидемиология), понимание сущности деталей различных дизайнов клинических исследований |
Интеллектуальное руководство исследованием |
Анализ предварительных результатов с целью контроля условий исследования и возможного изменения плана исследования |
Понимание методических проблем исследования, профессиональная интуиция, владение методами предварительного оценивания цифровых результатов |
Оценка результатов исследования |
Выбор адекватной статистической модели; |
Знание клинической эпидемиологии и биостатистики; |
Оценка влияния вмешивающихся факторов и валидности результатов исследования; |
Глубокое понимание теории процесса/явления. Широта научных и клинических взглядов; |
|
Описание причин возникновения систематических ошибок; |
Тоже, а также понимание деталей методических подходов в исследовании. |
|
Интерпретация результатов статистического анализа; |
Умение оценить и отличить статистическую и клиническую значимость результатов исследования. |
|
Формулировка нового научного факта; |
Знание «старой парадигмы», широта научных взглядов. |
|
Оценка верности предварительной гипотезы, новых фактов и перспектив дальнейших исследований |
Широта научных взглядов, знание теории объекта исследования и научной методологии |
|
Написание научной работы |
Выбор формата публикации; |
Знание теории публикационной практики; |
Формулировка основных идей, результатов исследования, обобщений и выводов |
Глубокое понимание теории процесса/явления, умение выделить главное в результат исследования и правильно формулировать мысли; |
|
Графическое и цифровое представление результатов статистического анализа.; |
Знание биостатистики |
|
Коррекция написанной научной работы |
Является новым авторским вкладом в соответствии с вышеуказанными категориями. |
Требует всех вышеизложенных качеств и научной опытности |
Исходя из мирового опыта, можно заключить, что есть две группы общественных и государственных организаций, которые обязаны взять ответственность за развитие института авторства. Это редакции журналов и университеты.
Рекомендации издательской группы журнала Nature – самого рейтингового и авторитетного мирового научного издания дополняют представленную схему, точно и емко отображают принципы института авторства: «Все исследовательские институты, журналы и научные сообщества должны проводить на местах формальную политику авторства. Порогом авторства в научной публикации должен быть прямой и существенный интеллектуальный вклад в исследование. Все авторы должны участвовать в написании рукописи. Как минимум, каждый автор должен написать, по крайней мере, часть рукописи, в которой обозначен авторский вклад и за этот вклад автор должен быть готов взять общественную ответственность» [38].
Следует заметить, что не стоит ждать, добровольной декларации авторского вклада – в этом вопросе в отечественном научном сообществе существуют отчетливые конфликты интересов. Например, известный рейтинговый журнал JAMA до 2001 года только рекомендовал указывать авторский вклад. Но большинство авторов проигнорировало этот вопрос. Начиная с января 2001 года, JAMA перестала публиковать какие либо статьи без указания всеми авторами вклада в публикацию. В Украине возможна реализация простого механизма развития института авторства. Для этого ВАК Украины может издать указ, который обяжет во всех зарегистрированных в ВАК Украины журналах представлять в начале каждой публикации авторский вклад каждого соавтора. В этом случае исчезнет потребность описывать авторский вклад в авторефератах диссертаций, которые публика не читает (нет фактического доступа) и поэтому нет возможности проверить правдивость указания авторского вклада.
2. Методология современного клинического исследования
Современная клиническая наука, как никогда раньше близка к точным наукам, так как на протяжении последней четверти прошлого века была создана и активно развивалась новая фундаментальная клиническая наука –клиническая эпидемиология.
2.1. Клиническая эпидемиология – теоретическая основа современного клинического исследования
Эпидемиологические методы изучения заболеваемости давно перестали быть прерогативой специалистов в области инфекционных заболеваний. В современном научном международном медицинском сообществе эпидемиология рассматривается как наука, которая изучает закономерности распространение и методы исследования любых болезней. Эпидемиология неинфекционных заболеваний в настоящее время рассматривается как «пропедевтическая дисциплина медицины и содержит основы понимания медицинской реальности, эффективности вмешательств и методов исследований в медицине» [39, с.9]. Клиническая эпидемиология рассматривается как «наука позволяющая осуществить прогнозирование для каждого конкретного пациента на основании изучения клинического течения болезни в аналогичных случаях с использованием строгих научных методов изучения групп больных для обеспечения точности прогноза» [ 40, с.12].
В странах постсоветского пространства до сих пор отсутствовала традиция обучению предмету эпидемиологии неинфекционных заболеваний и клинической эпидемиологии, в частности. Это обстоятельство создает глухой интеллектуальный барьер для наших ученых по отношению к мировому медицинскому информационному пространству. Поэтому каждому нашему соотечественнику не следует оглядывается на своих коллег и практиковать прежние традиции клинической науки. Следует активно самостоятельно обучаться. Для такого самообучения, в частности можно рекомендовать русскоязычное издание всемирно известных американских эпидемиологов Сюзанны и Роберта Флетчер в соавторстве с Эдуардом Вагнером: «Клиническая эпидемиология: основы» [40]. Русскоязычный вариант книги называется: «Клиническая эпидемиология: основы доказательной медицины». Также значительно расширяет понимание предмета клинической эпидемиологии первый русскоязычный учебник эпидемиологии неинфекционных заболеваний [39].
Главный принцип клинической эпидемиологии заключается в том, что обязательным предметом клинических явлений является так называемый «клинический исход», а не биологические явления, такие как результаты лабораторных и функциональных методов исследования. В общем случае под клиническими исходами подразумевается альтернативы понятиям жизнь и здоровье, которые формулируются как: смерть, заболевание, дискомфорт, инвалидизация, неудовлетворенность. Формулировка вероятности ожидаемого клинического эффекта в клинической эпидемиологии обеспечивается количественным подходом при изучении клинических явлений. Следующий принцип заключается в том, что каждая исследуемая группа рассматривается как выборка из популяции с определенными социо-биологическими особенностями. Большая часть клинической эпидемиологии посвящается тому, как избежать, или минимизировать систематические ошибки путем качественного планирования и организации клинических исследований, и как правильно учесть случайную ошибку при помощи адекватных статистических методов обработки результатов исследований. Исходя из принципа выборка-популяция, каждое исследование имеет характеристики достоверности, которая отражает справедливость полученных результатов по отношению к выборке и обобщаемости, которая определяет в какой мере результаты данного исследования применимы к другим группам.
С точки зрения клинической эпидемиологии наиболее важными понятиями, которые должны обязательно раскрываться в современной клинической публикации являются: объявление дизайна исследования, критерии включения/исключения в/из исследование(я), определение целевых клинических исходов и выражение результатов исследования при помощи определенных эпидемиологических параметров.
2.2. Типовые дизайны клинических исследований
В мировой клинической практике типовой общи характеристики клинического исследования обозначаются понятием дизайн (design), что одновременно означает план, замысел, проект и конструкцию клинического исследования. Дизайн клинического исследования является ключевым понятием в современной клинической журнальной публикации, поскольку его формулировка есть не что иное как строгая математическая формула с использованием знаков высокой дифференциации с точными понятийными определениями. За каждым из таких сложных знаков формулы дизайна клинического исследования стоит соответствующий объект исследования, изучаемая сторона объекта исследования, ограничения выбранного методологического подхода и предполагаемые статистические методы оценки результатов клинического исследования. Свободное владение языком этих формул требует доскональных знаний клинической эпидемиологии и является визитной карточкой методологической зрелости клинического исследователя. Именно по этой причине объявление детализированной формулы дизайна клинического исследования в журнальной публикации и в структурированном реферате становится стандартом публикационной клинической практики.
Для ориентирования в типах дизайнов клинических исследований необходимо свободно владеть специальной терминологией. В настоящее время на русском языке доступен качественный современный эпидемиологический словарь [41]. В тексте данных рекомендаций предлагаем основную терминологию дизайна клинического исследования
Описание случая (case report) — подробное изложение данных, полученных путем наблюдения одного или нескольких случаев [40, с. 257].
Когорта (cohort) — «группа лиц, изначально объединенных каким-либо общим признаком и наблюдаемых в течение определенного периода времени, чтобы проследить, что с ними произойдет в дальнейшем» [40, с. 129].
Систематическая ошибка, или смещение (bias) — это систематическое (неслучайное, однонаправленное) отклонение результатов от истинных значений [40, с. 18]. Различают несколько основных типов этих ошибок. Смещение, обусловленное отбором, возникает, когда сравниваемые группы пациентов различаются не только по изучаемому признаку, но и по другим факторам, влияющим на исход. Смещение, обусловленное измерением, возникает, когда в сравниваемых группах больных используются разные методы измерения. Смещение, обусловленное вмешивающимися факторами, возникает, когда один фактор связан с другим и эффект одного искажает эффект другого.
Случайная ошибка — следствие случайной вариации, которая является отклонением результатов (отдельного) наблюдения в выборке от истинного значения в популяции, обусловленное исключительно случайностью [40, с. 142].
Рандомизация — метод случайного отнесения больного к той или иной исследуемой группе [40, с. 163].
Слепой метод (маскированное вмешательство) — сохранение в тайне назначенного вмешательства от участников, медицинского персонала и лиц, осуществляющих сбор данных или оценку клинических исходов [13, с. 29].
Плацебо (placebo) — лекарственная форма, не отличимая от исследуемого препарата по внешнему виду, цвету, вкусу и запаху, но не оказывающая специфического действия [40, с. 178].
Поисковое клиническое исследование (exploratory) — исследование, в котором нет проверяемой гипотезы, а проверяется наличие достаточно сильных связей между различными клиническими показателями.
Описательное клиническое исследование (descriptive) — исследования распространенности болезней и особенностей заболеваний людей без вмешательства в происходящие события [39, с. 49].
Аналитическое клиническое исследование — исследование с обсервационным дизайном, в котором проверяют определенную клиническую гипотезу.
Продольное клиническое исследование (longitudinal) — исследование, в котором выделяется группа пациентов, которая прослеживается во времени и подвергается повторной оценке клинических характеристик.
Поперечное (одномоментное) клиническое исследование (cross-sectional) — исследование, в котором каждого пациента обследуют один раз [39, с. 43].
Проспективное клиническое исследование — исследование, в котором часть популяции формируется в группу и отслеживается во времени.
Ретроспективное клиническое исследование — исследование, в котором вначале формируют изучаемую группу пациентов, а затем по архивным данным отслеживают клинические характеристики вплоть до момента формирования групп.
Экспериментальные исследования — исследования, в которых исследователь определяет, кого подвергать воздействию [40, с. 128].
Контролируемые испытания (controlled trial) — клинические эксперименты, в которых результат вмешательства в основной группе сравнивается с результатом без вмешательства в контрольной группе [39, с. 47].
Неконтролируемые клиническое исследование — исследование, в котором описывают течение заболевания в одной группе пациентов, подвергающихся изучаемому вмешательству. Другое название этого метода — «исследование до — после» (before-after study). Подход основан на предположении, что любое улучшение, наблюдаемое после лечения, обусловлено именно лечением [40, с. 198].
Когортные исследования (cohort studies) — продольные и проспективные клиническое исследование, в которых вначале выделяются группы, а затем в этих группах в течение заданного времени регистрируются определенные новые клинические исходы. Когортное исследование может быть параллельным, когда когорта сформирована в настоящем и прослежена в будущем и историческим, когда когорта выделена по архивным документам и прослежена до настоящего времени [40, с. 129]. Понятие «когортное клиническое исследование» встречается достаточно часто, но по своим целям и главным признакам эта характеристика дизайна может относиться к совершенно разным по идеологии исследованиям.
Исследование случай — контроль (case-control study) — ретроспективное сравнительное исследование факторов риска в экспериментальной и контрольной группах.
Клинические испытания (clinical trials) — специальный вид когортных исследований, условия проведения которых (отбор групп вмешательства, характер вмешательства, организация наблюдения и оценка исходов) обеспечивают устранение систематических ошибок [40, с. 173].
Обсервационные исследования (observational studies) — клиническое исследование, в которых исследователь собирает данные путем простого наблюдения событий в их естественном течении, не вмешиваясь в них активно [40, с. 129].
Описание клинического случая (case report) — подробное изложение данных, полученных путем наблюдения одного или нескольких случаев [40, с. 257]. Это исследование относится к категории качественных исследований.
Исследование серий случаев (case series) — это изучение группы численностью 10 пациентов и более с определенным заболеванием. Это самый распространенный способ описания клинической картины заболевания [40, с. 261].
В руководствах по клинической эпидемиологии подробно описываются характеристики различных дизайнов клинических исследований [40], перечисляются и характеризуются возможные типовые планы клинических исследований [43], предлагается определенная классификация дизайнов клинических исследований. Все эти малоизвестные отечественному исследователю источники не могут быть отнесены к разряду простого знания и легкого чтения, тем более для практикующего врача. Понимание сущности различных дизайнов клинических исследований равносильно пониманию основных положений клинической эпидемиологии.
Существуют различные подходы к классификации дизайнов исследований. Чаще всего дизайны клинических исследований разделяются в зависимости от наличия или отсутствия гипотезы, которая лежит в основе исследования. При этом эпидемиологи говорят о существовании определенной шкалы: в левом углу находятся описательные и поисковые клинические исследования, а в правом — рандомизированные клинические испытания (РКИ). «Обязанность автора — четко пояснить, какому участку шкалы между крайними позициями (выдвижение гипотез — проверка гипотез) принадлежит его статья» [40, с. 316). Исходя из этого принципа, предлагаем следующую классификацию типовых дизайнов КИ (рис. 2).
КЛИНИЧЕСКИЕ ИССЛЕДОВАНИЯ |
||
ОБСЕРАЦИОННЫЕ |
ЭКСПЕРИМЕНТАЛЬНЫЕ |
|
ОПИСАТЕЛЬНЫЕ |
АНАЛИТИЧЕСКИЕ |
КЛИНИЧЕСКИЕ ИСПЫТАНИЯ |
Описание случаев |
Проспективное когортное |
Контролируемое |
Исследование серии случаев |
Историческое когортное |
Неконтролируемое (до-после) |
Одномоментные исследования |
Исследование случай-контроль |
Перекрестное |
Опросы |
|
На единственном больном |
Рис.2. Наиболее общая классификация дизайнов клинических исследований
Для выбора дизайна исследования, который будет соответствовать цели исследования может помочь следующая классификационная таблица (таб.3)
Таблица 3.
Классификационные признаки дизайнов клинических исследований
КРИТЕРИЙ РАЗЛИЧИЙ В ЗАВИСИМОСТИ ОТ: |
КАТЕГОРИЯ КИ |
ГЛАВНАЯ ХАРАКТЕРИСТИКА |
ОСНОВНАЯ ЦЕЛЬ |
зрелости определенной гипотезы |
Описательное |
Проводится на основе поперечных исследований и описаний случаев (серий случаев) |
Поиск закономерностей и формулировка гипотезы |
Аналитическое |
Оценивается вероятность определенной гипотезы в клиническом исследовании без вмешательства, путем наблюдения текущей клинической практики и естественного течения болезни |
Четкая формулировка гипотезы и получение нового теоретического знания |
|
Испытание |
Клинический эксперимент, высокого уровня доказательности в котором по определенному протоколу проверяется эффективность новых средств лечения |
Проверка гипотез, или верификация нового теоретического знания |
|
существующего уровня знаний |
Поисковые |
Существуют альтернативные гипотезы. Исследования в больших выборках. Сопоставление различных факторов, которые могут влиять на изучаемый исход |
Поиск возможных причин, генерация новых гипотез |
Проверяющие гипотезу |
Заранее до исследования формулируют клинический вопрос и применяют определенный дизайн исследования. |
Проверка нового теоретического знания |
|
временных характеристик исследований |
Одномоментные |
Каждого больного обследуют однократно. Описание заболевания, но не в процессе его развития, а по совокупности признаков, вариантов, тяжести течения. |
Описать картину болезни одного или группы больных, уточнить симптоматику, связать отдельные симптомы с диагнозом и тяжестью болезни. |
Проспективные (продольные) |
Группу больных формируют до начала исследования и прослеживают до момента проявления изучаемого клинического исхода |
Снижение систематической ошибки |
|
Ретроспективное |
Сопоставление состояния больных на момент исследования и факторов риска, которые изучены по архивным документам |
Снижение затрат на проведение исследования |
|
наличия контрольной группы |
Контролируемые |
Наличие контрольной группы, в которой изучаемый клинический исход сопоставляется с исходом в опытной группе |
Увеличение доказательности |
Не контролируемые |
Отсутствует группа контроля. Ведется сбор клинической информации в динамике заболевания или в сопоставлении до-после лечения, или в перекрестном дизайне клинического исследования |
Цель определяется задачами клинического исследования |
|
степени маскирования (ослепления) |
Открытое |
Испытание, в котором не скрывается назначение вмешательства |
Снижение затрат на РКИ, упрощение протокола испытания |
Слепое |
Сохранение в тайне назначенного вмешательства с различной степенью маскирования (см. текст) |
Снижение систематической ошибки |
|
метода включения в исследование |
По критерию включения |
Группы исследования формируются по определенным демографическим и клиническим признакам |
Целенаправленное формирование групп исследования с определенными признаками для увеличения достоверности |
Рандомизированное |
Случайное распределение больных, обеспечивающее равные шансы попасть в ту или иную группу испытания |
Снижение систематической ошибки |
|
Кластерная рандомизация |
Методический прием, который позволяет снизить систематическую ошибку и изучить влияние отдельного клинического фактора на исход |
Снижение систематической ошибки, увеличение обобщаемости |
|
степени представительства генеральной совокупности |
Качественные |
Исследование типа описания случаев |
Изучение патогенеза, исследование редких форм заболеваний, генерация новых гипотез |
Количественные |
Исследования, в результате которых формулируется вероятность изучаемого прогноза в цифровом виде |
Обеспечение эпидемиологического подхода в клиническом исследовании |
2.3. Критерии включения/исключения в/из исследование(я)
Любое клиническое исследование имеет две характеристики так называемой валидности: внутреннюю и внешнюю.
Достоверность исследования (internal validity) определяется тем, в какой мере полученные результаты справедливы в отношении данной выборки [40, с. 24].
Обобщаемость исследования (external validity, или generalizability) — определяется тем, в какой мере результаты данного исследования применимы к другим группам больных [40, с. 24]. При соблюдении прочих стандартных условий в клиническом исследовании в высокоселективных группах исследователи получают более высокую достоверность исследования, но худшую обобщаемость результатов клинического исследования по отношению к популяции в целом. Высокая достоверность клинического исследования более соответствует требованиям клинической эпидемиологии, в соответствии с которыми необходимо «осуществить прогнозирование для каждого конкретного пациента». В таком случае предполагается, что в определенном исследовании характеристики «конкретного пациента» в идеальном случае совпадают с характеристиками группы определенного клинического исследования.
Критерии включения (admission criteria) — клинические и демографические характеристики, которые должны присутствовать у участников КИ [13, с. 28].
Критерии исключения — условия, определенные заранее, до начала исследования, в соответствии с которыми случаи выводятся из исследования для обеспечения однородности групп и достоверности клинического исследования.
Чем более точно сформирована выборка по определенным критериям включения/исключения, тем меньше вероятность та называемой систематической ошибки исследования. Следует помнить, что строгие критерии включения уменьшают вероятность систематической ошибки исследования, но снижают обобщаемость результатов исследования на более широкую когорту из генеральной совокупности определенного клинического состояния.
В публикации, в разделе материалы и методы при описании особенностей дизайна клинического исследования необходимо точно и однозначно описать критерии включения/исключения в/из исследование(я).
2.4. Референтные критерии и клинические исходы.
Клинические исходы — исходы, имеющие наибольшее значение для больных и для медицинского персонала (смерть, наличие заболевания, дискомфорт, инвалидизация, неудовлетворенность). Биологические явления не могут считаться эквивалентом клинических исходов, пока не получено прямых доказательств их взаимосвязи [40, с. 16].
Суррогатные (косвенные) исходы (surrogate outcomes.) — лабораторный показатель или симптом, который заменяет клинически значимый исход, прямо характеризующий самочувствие больного, его функциональное состояние и выживание [42]. Считается оправданным использовать суррогатные исходы только в том случае, когда известно, что косвенный исход сильно связан с клиническим исходом [40, с. 187]. Использование косвенных критериев считается оправданным в клинических испытаниях 2-й фазы для выявления того, является ли новый вид вмешательства биологически активным, а также для принятия принципиального решения о достаточной перспективности нового вида вмешательства, оправдывающего проведение крупного окончательного исследования с использованием клинически значимых исходов. В окончательных клинических испытаниях 3-й фазы, за исключением редких случаев, когда обоснованность применения косвенного критерия оценки неопровержимо доказана, в качестве основного критерия оценки должен использоваться истинный клинический исход [42].
Референтный метод диагностики (золотой стандарт диагностики) — некоторый точный способ определения болезни, то есть заслуживающий доверия [40, с. 62]. В качестве референтного метода могут выступать и клинический и суррогатный исход в зависимости от клинической ситуации. Например, при сахарном диабете показатель концентрации сахара в плазме крови (суррогатный критерий) является референтным методом диагностики наличия заболевания.
Главной отличительной характеристикой клинического исследования является учет в исследовании клинических исходов как главных конечных точек исследования. Если в исследовании не учитываются клинические исходы, тогда такое исследование следует отнести к категории изучения механизмов заболевания (патофизиологическое, биохимическое, морфологическое и пр.). Исходя из этих условий, в публикации следует однозначно и четко обозначить изучаемые клинические исходы и обосновать используемые референтные методы диагностики для оценки клинических исходов.
2.5. Определение целевых цифровых эпидемиологичечских параметров клинического исследования
В результате любого клинического исследования ожидается получение цифровых характеристик. Эти цифровые характеристики могут отражать две категории изучаемых клинических явлений: статистическую значимость и клиническую значимость. Для фундаментальной науки актуальны факты статистической значимости различий клинических признаков, а для медицинской практики используются определенные эпидемиологические характеристики. Эти эпидемиологические характеристики являются важнейшим прикладным результатом клинического исследования. Основная проблема состоит в том, что вся текущая качественная клиническая информация выражена на языке эпидемиологических параметров, но из за отсутствия базовой подготовки в области клинической эпидемиологии отечественный исследователь чаще всего не умеет выражать результаты клинического исследования на языке эпидемиологических характеристик, а наши врачи не понимают этого современного научно-медицинского языка.
Главными эпидемиологическими категориями являются прогноз, риск, эффективность и различные характеристики диагностических тестов
Прогноз — предсказание будущего течения болезни [40, с.141].
Риск — вероятность какого-либо неблагоприятного события [40, с.121].
Эффективность — часть риска, которая устраняется с помощью изучаемого вмешательства при изучении лечения и профилактики заболеваний.
Чувствительность диагностического теста определяется как доля лиц с положительными результатами теста в популяции с изучаемым заболеванием [40, с. 67].
Специфичность диагностического теста определяется как доля лиц с отрицательными результатами теста в популяции без изучаемой болезни [40, с. 68].
В соответствии с целью исследования в клинической публикации должны быть представлены целевые эпидемиологические характеристики изучаемых клинических явлений, такие как: абсолютный риск, относительный риск, шансы, число больных которых необходимо лечить, чтобы получить в одном случае ожидаемый клинический, чувствительность и специфичность диагностического теста и другие.
3. Биостатистика
Существует два крайних подхода при использовании методов биостатистики в клинических исследованиях. Приверженцы первого считают, что план врач-исследователь может полностью переложить вопросы статистического анализа на плечи профессиональных статистиков, другие исследователи проблемы предлагают исследователям самостоятельно осваивать и использовать методы статистического анализа. В развитой модели клинической науки, при достаточной финансовой поддержке клинического исследования включение профессионального биостатистика в исследовательскую группу можно считать оправданным, но в реалиях отечественных клинических исследований лучше полагаться на собственные знания основных положений биостатистики.
Биостатистика является самостоятельным сложным научным предметом. Некоторые методы статистического анализа требуют достаточно глубоких профессиональных знаний для их правильного использования. С другой стороны отечественная публикационная практика характеризуется крайне низким качеством использования биостатистических методов в публикациях. Эти ошибки достаточно типичны, их анализу посвящено множество публикаций. В рамках данных рекомендаций невозможно осветить весь спектр методов биостатистического анализа. С другой стороны, крайне низкий общий уровень представления результатов биостатистического анализа в отечественных журнальных публикациях требует сделать акцент на основных, наиболее распространенных ошибках.
3.1. Описание методов статистического анализа в публикации
При статистической обработке результатов исследования используются статистические тесты, которые определены заранее в плане (протоколе) исследования до начала набора материала исследования. В публикациях в разделе «Материалы и методы» рекомендуется использовать специальный подраздел: «Методы статистического анализа». В этом разделе должны быть указаны: все используемые в исследовании статистические методы, обоснования выбора статистического теста для решения определенных задач, нормальность распределения выборочны данных. Для обозначения уровня ошибки первого рода строго рекомендуется использовать понятие «уровень статистической значимости», который чаще всего обозначается как «p». При проверке гипотез и обосновании выводов публикации следует использовать точные значения уровня статистической значимости «p», а при проведении поисковых фрагментов исследования для обнаружения определенных закономерностей допустимо использовать заранее определенные диапазоны значений «p». Использование альтернативных статистических подходов для решения одной и той же статистической задачи требует соответствующего обоснования и разъяснения.
В тексте публикации по ходу изложения результатов исследования следует ясно указать, какой статистический тест использован для получения данного р-значения и насколько согласуются анализируемые данные с допущениями для использования данного статистического теста. В случае коротких сообщений эти сведения должны сообщаться в тексте или отражаться на рисунках и в подписях к ним.
3.2. Формат описания выборочных характеристик клинического исследования
Особое внимание рекомендуется уделить описанию формата представления выборочных характеристик в подразделе «Методы статистического анализа». Выборочные данные должны быть представлены в виде меры положения (среднее, мода, медиана) и меры рассеяния (стандартное отклонение, стандартная ошибка, заданный доверительный интервал, размах, квартили, процентили, выбросы). Для малых выборок размах является более приемлемым, чем стандартное отклонение. При указании выборочной характеристики необходимо указывать размер выборки (n) для каждого набора данных. Авторы обязаны указывать, являются ли числа, следующие за знаком ± (или в скобках), стандартными ошибками среднего или стандартным отклонением, или, что более предпочтительно, доверительным интервалом заданной точности.
Для нормально распределенных данных рекомендуется использовать следующий стандарт представления выборочных данных M(xL, xH, n=a),
где:
M – среднее значение;
xL - нижнее значение 95% доверительного интервала;
xH, - верхнее значение 95% доверительного интервала;
n=a – обозначение объема выборки исследуемой совокупности.
Для данных, распределение которых отличается от нормального закона рекомендуется использовать медианно-квартильное представление выборочных характеристик в аналогичном формате.
Для данных с малыми объемами выборки (<10) рекомендуется также указывать верхнее и нижнее значение данных выборки.
3.3. Сравнение независимых групп
Сравнение двух групп является наиболее типичной задачей клинического исследования. При соблюдении нормального закона распределения и сопоставимости дисперсий количественных данных предпочтительно использование вычисление уровня значения «p» с использование t-теста Стьюдента с указанием конкретного варианта этого теста. Ели данные не соответствуют условиям применения t-теста Стьюдента, тогда должен использоваться один из вариантов непараметрической альтернативы статистического теста.
Одной из распространенных ошибок является использование t-теста для множественных сравнений без учета соответствующих поправок. В таких случаях качественной альтернативой является использование дисперсионного анализа.
3.4. Статистический анализ в исследованиях «до – после»
При исследовании связанных групп в исследования с дизайном «до-после» необходимо использовать соответствующие статистические тесты с учетом параметров распределения выборки. В этом случае следует избегать сопоставления средних значений двух и более выборок при наличии противоположенных тенденций динамики показателей в подгруппах. Для обнаружения противоположенных тенденций до и после воздействия рекомендуется использование простых графиков изменения показателей в каждом случае на одном листе.
3.5. Статистический анализ в диагностических исследованиях
При изучении диагностических тестов современным стандартом является обязательное определение специальных характеристик. В основе этих расчетов лежит построение характеристической кривой диагностического теста (ROC – curve) и вычисление показателей чувствительности и специфичности при заданной точке разделения. Определение показателя «прогностической ценности теста» на основе вычисленных характеристик чувствительности и специфичности при заданной точке разделения является наиболее точной клинической характеристикой изучаемого метода диагностики.
3.6.Визуализация результатов статистического исследования
Некачественная графическая визуализация статистических результатов исследования часто является средством манипулирования мнением читателей. Наиболее актуален вопрос построения графиков результатов статистического анализа для представления выборочных характеристик. Современным стандартом таких графиков является так называемый график «ящик с усами», который при нормальном распределении исследуемой выборки может содержать информацию о среднем, стандартной ошибке и 95% доверительных интервалах среднего.
При распределении, отличающемся от нормального, на вышеуказанном графике асимметрия данными скрывает структуру изучаемых выборок. Поэтому в таком случае график должен отражать информацию о значении медианы, квартилей (процентилей) и значения выбросов отдельных данных.
В диагностических исследованиях представление графика характеристической кривой является обязательным.
В научных публикациях исследованиях не рекомендуется использовать красочные, трехмерные, конусообразные и прочие графики - каждый элемент украшения графика обязан нести, прежде всего, содержательную информацию.
Литература
1. Воробьев К.П. Рекомендации по представлению результатов клинических исследований в диссертациях и журнальных публикациях. Часть 1. Основные положения // Клиническая информатика и телемедицина, 2010, № 6(7).- С.166 - 173.
2. JAMA & Archives Journals / АMA Manual of Style: A Guide for Authors and Editors. Oxford University Press, USA, 2007, 1032 p. (http://www.amazon.com/AMA-Manual-Style-Au-thors-Editors/dp/0195176332/ref=pd_sim_b_5).
3. Council of Science Editors / CSE’s White Paper on Promoting Integrity in Scientifc Journal Publications, 2006 (http:// www.councilscienceeditors.org/editorial_policies/white_paper.cfm).
4. CSE Style Manual Subcommittee / Scientifc style and format (The CSE Manual for Authors, Editors, and Publishers). Seventh Edition, Council of Science Editors, 2006, 680 p. (http://www.councilscienceeditors.org/publications/style.cfm).
5. Dodd J.S. (Ed.) The ACS style guide: a manual for authors and editors. 2nd ed. Washington (DC): American Chemical Society, 1997, 472 p. (http://www.arnazon.com/ACS-Style-Guide-Aufhors-Editors/dp/0841234620).
6. University of Chicago Press Staf (Ed.) The Chicago manual of style: the essential guide for writers, editors, and publishers. 15th ed. Chicago (IL): University of Chicago Press, 2003, 984 p. (http://www.amazon.com/Chicago-Manual-Style-University-Press/dp/0226104036).
7. Всемирная ассоциация медицинских редакторов. Рекомендации всемирной ассоциации медицинских редакторов по принципам этики научных публикаций в медицинских журналах // Международный журнал медицинской практики, 2005.- № 5.- С. 24 - 30 (http://www.mediasphera.ru/journals/practik/169/2382/).
8. EASE The Science Editors’ Handbook. EASE: Guilford, 2003, 406 p. (http://www.ease.org.uk/ese.html).
9. Jacobs A., Wager E. European Medical Writers Association (EMWA) guidelines on the role of medical writers in developing peer-reviewed publications // Curr. Med. Res. Opin., 2005.- V. 21.- № 2.- P. 317–322 (http://www.emwa.org/Mum/EMWAguide-lines.pdf).
10. Moher D., Jones A., Lepage L., et al. CONSORT Group (Consolitdated Standards for Reporting of Trials) Use of the CONSORT statement and quality of reports of randomized trials: a comparative before-and-after evaluation // JAMA.- 2005.- V. 285.- № 15.- P. 1992 - 1995 (http://jama.ama-assn.org/cgi/re- print/285/15/1992.pdf).
11. Moher D., Schulz K.F., Altman D.G., et al. CONSORT GROUP (Consolidated Standards of Reporting Trials) The CONSORT statement: revised recommendations for improving dhe quality of reports of parallel-group randomized trials // Ann. Intern. Med., 2001.- V. 134.- № 8.- P. 657 - 662 (http://www.annals.org/cgi/re-print/134/8/657.pdf).
12. Altman D.G., Schulz K.F., Moher D., et al. CONSORT GROUP (Consolidated Standards of Reporting Trials) The revised CONSORT statement for reporting randomized trials: explanation and elaboration // Ann. Intern. Med., 2001.- V. 134.- № 8.- P. 663 - 694 (http://www.annals.org/cgi/reprint/134/8/663.pdf).
13. Альтман Д.Г., Шулыц К.Ф., Мохер Д., и соавт. Пересмотренный вариант единых стандартов представления результатов рандомизированных контролируемых испытаний (CONSORT): разъяснения и перспективы дальнейшего усовершенствования // Международный журнал медицинской практики, 2005.- № 5.- С. 5 - 34 (http://www.mediasphera.ru/mjmp/2001/5/r5-01-1.htm).
14. Plint A.C., Moher D., Morrison A., et al. Does the CONSORT checklist improve the quality of reports of randomised controlled trials? // A systematic review. Med. J. Aust, 2006.- V. 185.- № 5.- P. 263 - 267 (http://www.mja.com.au/public/issues/185_05_040906/pli11098_ fm.html).
15. Moher D., Cook D.J., Eastwood S., et al. Improving the quality of reports of metaanalyses of randomised controlled trials: the QUOROM statement. Quality of Reporting of Meta-analyses // Lancet, 1999.- V. 354.- P.1896 - 1900.
16. Bossuyt P.M., Reitsma J.B., Bruns D.E., et al. Standards for Reporting of Diagnostic Accuracy. Towards complete and accurate reporting of studies of diagnostic accuracy: The STARD Initiative // Ann. Intern. Med., 2003.-V. 138.- № 1.- P. 40 - 44 (http://www.annals.org/cgi/reprint/138/1/40.pdf).
17. Stroup D.F., Berlin J.A., Morton S.C., et al. Meta-analysis of observational studies in epidemiology: a proposal for reporting. Meta-analysis Of Ob-servational Studies in Epidemiology (MOOSE) group // JAMA, 2000.- V. 283.- № 15.- P. 2008 - 2012 (http://jama.ama-assn.org/cgi/re-print/283/15/2008.pdf).
18. Международная конференция по гармонизации технических требований к регистрации лекарственных препаратов для человека (IСH). Руководство по надлежащей клинической практике // Укр. мед. часопис, 2002.- № 1.- С. 65 – 96 (http://www.umj.com.ua/pdf/27/umj_27_1276.pdf).
19. Wager E., Field E.A., Grossman L. Good publication practice for pharmaceutical companies // Current Medical Research & Opinion, 2003.- V. 19.- № 3.- P. 149 - 154 (http://ebasic.easily.co.uk/03100E/00605D/GPP.pdf).
20. The PLoS Medicine Editors. Making sense of non-financial competing interests // PLoS Med, 2008.- №. 5(9).- e199 (http://www.plosmedicine.org/ article/info:doi/10.1371/journal.pmed.0050199).
21. Cain D.M., Detsky A.S. Everyone's a little bit biased(even physicians) // JAMA, 2008.- V. 299.- № 24.- P. 2893 – 2895 (http://jama.ama-assn.org/cgi/content/extract/299/24/2893).
22. Wager E., Parkin E.C., Tamber P.S. Are reviewers suggested by authors as good as those chosen by editors? Results of a rater-blinded, retrospective study // BMC Med., 2006.- № 4.- P. 13 (http://www.pubmed-central.nih.gov/articlerender. fcgi?artid=1482713).
23. Bostanci A. Germany Gets in Step With Scientific Misconduct Rules // Science, 2002.- V. 296(5574).- P. 1778 (http://www. sciencemag.org/cgi/content/ full/296/5574/1778a).
24. Department of Health and Human Services. Public Health Service Policies on Research Misconduct; Final Rule // Federal Register, 2005.- № 70(94) (http://ori.dhhs.gov/documents/42_cfr_parts_50_and_93_2005.pdf).
25. CSE's White Paper on Promoting Integrity in Scientific Journal Publications. Editorial Policy Committee / Council of Science Editors, 2005 (http://www.councilscienceeditors.org/editorial_policies/whitepaper/entire_whitepaper.pdf).
26. Callaham M.L. Journal policy on ethics in scientific publication // Ann Emerg Med.- 2003.- V. 41.- P. 82 - 89.
27. Smith J. Gift authorship: a poisoned chalice? [editorial] // Br Med J.- 1994.- V. 309.- P. 1456 - 1457.
28. Kakkar N. Authorship trends in the Indian Journal of Pathology and Microbiology: going the global way? // Journal of Clinical Pathology, 2004.- V. 57.- P. 670.
29. Raveendran R. Abuse of authorship // Indian J Pharmacol, 2004.- V. 36.- № 3.- P. 131 - 132.
30. Smith R. Medical journals are an extension of the marketing arm of pharmaceutical companies // Plos Medicine, 2005.- V. 2.- № 5.- P. 364 - 366.
31. Gotzsche P.C., Hrobjartsson A., Johansen H.K., et al. Ghost authorship in industry-initiated randomised trials. // PLoS Med, 2007.- V. 4.- e19 (http://dx.doi.org/10.1371%2Fjournal.pmed.0040019).
32. Sismondo S. Ghost Management: How Much of the Medical Literature Is Shaped Behind the Scenes by the Pharmaceutical Industry? // PLoS Med, 2008.- V. 4.- P. 9 (http://www.pubmedcentral.nih.gov/articlerender.fcgi?artid=1989751).
33. Ross J.S., Hill K.P., Egilman D.S., Krumholz H.M. Guest Authorship and Ghostwriting in Publications Related to Rofecoxib // JAMA, 2008.- V. 299.- № 15.- P. 1800 - 1812 (http://jama.ama-assn.org/cgi/content/abstract/299/15/1800).
34. Yank V., Rennie D. Disclosure of Researcher Contributions: A Study of Original Research Articles in The Lancet // Academia and clinic, 1999.- V. 130.- № 8.- P. 661 - 670.
35. Bates T., Ani A., Marui M., Marui A. Authorship Criteria and Disclosure of Contributions Comparison of 3 General Medical Journals With Different Author Contribution Forms. JAMA, 2004.- V. 292.- P. 86 - 88.
36. Hren H., Sambunjak D., Ivani A., Marui M., Marui A. Perceptions of authorship criteria: effects of student instruction and scientific experience // Journal of Medical Ethics, 2007.- V. 33.- P. 428 - 432.
37. Friedman P.J. A New Standard for Authorship (http://www.councilscienceeditors.org/services/friedman_article.cfm).
38. Nature Publishing Group. Ethics and fraud // Nature, 2006.- V. 439.- P. 117 - 118 (http://sps.nus.edu.sg/~kohchinw/Retraction/Ethics%20and%20fraud%20-%20Three%20cheers%20for%20peers.pdf).
39. Власов В.В. Эпидемиология, ГЭОТАР-МЕД, 2004.- 464с.
40. Флетчер Р., Флетчер С., Вагнер Э. Клиническая эпидемиология: основы доказательной медицины, М.: МедиаСфера, 1998.- 350с.
41. Эпидемиологический словарь. Ред. Джон М. Ласта, М., 2009, 316с.
42. Fleming T.R., DeMets D.L. Surrogate end points in clinical trials: are we being misled? // Ann. Intern. Med., 1996.- V. 125.- № 7.-P. 605 – 613.
43. Гринхальх Т. Основы доказательной медицины. ГЭОТАР-МЕД, 2004, 240 с.