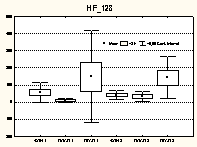
Рис. 1 Изменения вегетативной регуляции в ПОСП и ПКСП по сравнению с фоном в младшей возрастной группе больных РС (1 – 1-я группа; 2 – 2-я группа)
|
|||||||||
СВЯЗЬ ОСОБЕННОСТЕЙ ВЕГЕТАТИВНОЙ РЕГУЛЯЦИИ И ЭФФЕКТИВНОСТИ ЛЕЧЕНИЯ ПРИ РАССЕЯННОМ СКЛЕРОЗЕ |
|||||||||
|
Обследован 91 больной рассеянным склерозом (средний возраст – 36,0±10,5 лет, средняя длительность болезни – 8,8±7,7 лет, тяжесть состояния по шкале Expanded Disability Status Scale (EDSS) – 3,8±1,3) в покое, во время пассивной ортостатической пробы (ПОСП) и пробы с глубоким медленным дыханием. По изменениям показателей вариабельности ритма сердца в этих тестах с помощью кластерного анализа больные были разделены на группы с различным состоянием регуляторных механизмов.
В младшей возрастной группе с положительным лечебным эффектом сочеталось снижение вагусной активности и увеличение степени синхронизации процессов регуляции при проведении ПОСП, в средней – уменьшение вагусных и барорецепторных влияний в ПОСП, восстановление их уровня при возвращении в клиностатическое положение и сохранение низкой степени напряжения регуляторных систем в пробах с изменением положения тела. В старшей возрастной группе эффективность лечения была связана с отсутствием изменений вагусной активности и периода максимальной мощности высокочастотного диапазона при переменах положения тела.
Ключевые слова: рассеянный склероз, вариабельность ритма сердца, вегетативная нервная система, вегетативные пробы.
CONNECTION BETWEEN PECULIARITIES OF AUTONOMIC REGULATION AND EFFICIENCY OF TREATMENT AT THE MULTIPLE SCLEROSIS
Yu.N. Sorokin, K.P. Vorobjev
91 patients with multiple sclerosis (mean age – 36,0±10,5 years, mean duration of illness – 8,8±7,7 years, severity of condition – 3,8±1,3 points on EDSS) have been investigated in rest, during passive orthostatic test and test with deep slow breath. According to changes of indicators of heart rate variability in these tests by means of the cluster analysis patients have been divided into groups with different condition of regulatory mechanisms.
In junior age group depression of vagal activity and augmentation of degree of synchronisation of regulatory processes at carrying out tilt-test was combined with positive medical effect, in mean age group – reduction of vagal and baroreceptor influences in till-tests, restoration of their level at returning in clinostatic position and preservation of low strain degree of regulatory systems in tests with change of body position. In senior age group efficiency of treatment has been connected with absence of changes of vagal activity and the period of maximal power of high-frequency range.
Keywords: multiple sclerosis, heart rate variability, autonomic nervous system, autonomic tests.
Переход в ортостатическое положение позволяет оценить адаптивно-компенсаторные возможности организма, при этом расстройства вегетативной регуляции выявляются у 50% больных РС [7]. Более информативной признана пассивная ортостатическая проба (ПОСП) [1], показавшая связь изменений вариабельности ритма сердца (ВРС) у больных РС с общим объемом МРТ-повреждений среднего мозга [9]. Продемонстрирована необходимость учета возрастных и гендерных различий при анализе вегетативной регуляции при РС [3, 5], показано, что длительность заболевания больше влияет на вегетативную дисфункцию, чем степень инвалидизации [6, 8]. Состояние вегетативных механизмов коррелирует с выраженностью аксональной дегенерации и с активностью патологического процесса [10] и может влиять на эффективность лечения (ЭФЛ).
Цель работы: Установить связь динамики вегетативной регуляции по данным ВРС при проведении вегетативных тестов с ЭФЛ при РС.
ОБЪЕКТ И МЕТОДЫ ИССЛЕДОВАНИЯ
Дизайн: Открытое проспективное обсервационное исследование текущей клинической практики.
Пациенты: Обследован 91 больной РС – 69 женщин и 22 мужчины, средний возраст – 36,0±10,5 лет, средняя длительность болезни – 8,8±7,7 лет, тяжесть состояния по шкале Expanded Disability Status Scale (EDSS) – 3,8±1,3. Пациенты были разделены на 3 возрастные группы: юноши (17-21 год) и девушки (16-20 лет), I (мужчины 22-35 лет и женщины 21-35 лет) и II периоды зрелого возраста (мужчины 36-60 лет, женщины 36-55 лет).
Методы: С помощью поворотного стола с возможностью подъема его в вертикальное положение с углом наклона 80? осуществляли ПОСП. Для оценки состояния сегментарного парасимпатического уровня регуляции с усилением вагусных влияний проводили пробу с глубоким медленным дыханием – 6 раз в 1 минуту (ГМД).
ВРС исследовали в состоянии покоя, во время проведения вегетативных проб и при возвращении в клиностатическое положение (ПКСП). Объем каждой выборки составлял 128 кардиоинтервалов. Запись осуществлялась с помощью ритмокардиоанализатора, изготовленного на основе промышленного устройства и прошедшего государственную метрологическую аттестацию (свидетельство № Р 41/М-329-04), и нашей сертифицированной программы [2]. Программа анализа спектральных характеристик сердечного ритма прошла метрологическую аттестацию при помощи генератора эталонных сигналов по методу Е.А. Паламарчука [4].
Анализировались следующие показатели ВРС: средняя длительность кардиоинтервалов (meanR_R, мс), стандартное отклонение полного массива кардиоинтервалов (StandDev, мс), индекс напряжения регуляторных систем (i_VegStr, 1/с2), доля пар кардиоинтервалов с разностью более 50 мс в общем числе кардиоинтервалов в массиве (PNN50, %), квадратный корень из суммы разностей соседних кардиоинтервалов последовательного ряда кардиоинтервалов (RMSSD, мс), значение первого коэффициента автокорреляционной функции (K1_AKF, ед.), максимальное и общее значение мощности спектра и период максимального значения в диапазоне высоких (max_HF, HF_128, мс2 и tMax_HF, с) и низких частот (max_LF, LF_128, мc2 и tMax_LF, с), отношение LF_128 к HF_128 (LF_to_HF, ед.).
С помощью кластерного анализа динамики показателей ВРС при проведении ПОСП и пробы с ГМД проводили разделение больных на группы с различным состоянием регуляторных механизмов.
Статистический анализ: Вычисляли среднее значение признака и стандартное отклонение (M±s). При сравнении нескольких групп применяли непараметрический метод сравнения независимых групп Краскела-Уоллиса (процедура дисперсионного анализа ANOVA). Для сопоставления двух независимых групп проверяли гипотезу о равенстве средних рангов с помощью U-критерия Манна-Уитни. При сравнении ВРС в различных состояниях в одной и той же группе использовали критерий знаков и критерий Вилкоксона для парных сравнений.
Данные на рисунках представлены в виде "коробочного" графика (box-and-whisker – "ящик с усами") с указанием средних значений, стандартной ошибки среднего (m) и 95% доверительных интервалов (ДИ). Статистический анализ и построение графиков выполнены в программе STATISTICA 6.0.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Среди юношей и девушек с помощью кластерного анализа динамики вегетативной регуляции при проведении ПОСП по сравнению с фоновыми значениями ВРС были выделены 2 группы с различными изменениями вегетативных показателей, которые характеризовались и различными ЭФЛ (р=0,024), длительностью болезни (р=0,037) и частотой обострений (р=0,050). По тяжести состояния различия статистически были менее значимыми (р=0,086).
Тип вегетативной реактивности, фоновые значения ВРС, ВРС в ПКСП и в пробах с давлением на рефлексогенные зоны статистически достоверных различий между группами не имели. В ПОСП в 1-й группе больных (с лучшим эффектом лечения) по сравнению с больными 2-й группы выявлены увеличение степени синхронизации регуляторных механизмов (K1_AKF, р=0,014) и уменьшение активности сегментарного парасимпатического уровня регуляции (PNN50, р=0,066; RMSSD, р=0,086; max_HF, р=0,086; HF_128, р=0,050) на фоне повышения относительной активности подкорковых симпатических центров (LF_to_HF, р=0,014). Такая динамика свидетельствует о достаточности адаптивно-компенсаторных механизмов в этой группе за счет включения более высоких уровней регуляции, по-видимому, эрготропных систем.
Повышенная парасимпатическая активность во 2-й группе сочеталась со сниженным значением периода максимальной мощности высокочастотного диапазона (tMax_HF, р=0,014), низкий уровень синхронизации и напряженности регуляторных механизмов при этом может указывать на разобщенность этих двух уровней регуляции.
При переходе в ортостатическое положение у пациентов этой группы на фоне укорочения средней величины кардиоинтервалов (meanR_R; р=0,043) наблюдалось менее выраженное снижение активности парасимпатического звена регуляции (max_HF; р=0,043) при уменьшении периода максимальной мощности в этом диапазоне (tMax_HF; р=0,068) и отсутствие изменений степени синхронизации и напряженности вегетативной регуляции и относительной активности подкорковых симпатических центров, что может отражать недостаточность адаптивно-компенсаторных механизмов вследствие разобщенности центральных и сегментарных уровней регуляции.
В 1-й группе также отмечалось укорочение средней величины кардиоинтервалов (meanR_R; р=0,068) и заметное снижение вагальной активности (PNN50, RMSSD, max_HF, HF_128; все – р=0,068), что сопровождалось повышением степени синхронизации и напряженности вегетативной регуляции и относительной активности подкорковых симпатических центров (K1_AKF, i_VegStr, LF_to_HF; все – р=0,068). Параметры активности сегментарного симпатического уровня регуляции ни в том, ни в другом случае изменений не претерпевали.
При возвращении в клиностатическое положение в этой группе наблюдалось снижение напряжения регуляторных механизмов (i_VegStr; р=0,068) до фоновых значений, во 2-й – это снижение отмечалось на фоне отсутствия изменений в ПОСП (р=0,043; с исходным состоянием – р=0,080). В 1-й группе до фоновых значений снижалась и степень синхронизации механизмов регуляции (K1_AKF; р=0,068), во 2-й группе этот показатель, как и в ПОСП, статистически достоверно не изменялся.
Таким образом, в этой возрастной когорте 1-я группа характеризовалась (рис. 1) выраженной подвижностью вегетативных механизмов в ПОСП: снижением вагусных влияний (HF_128, 95% ДИ: –3,9-24,4) и увеличением степени синхронизации процессов регуляции (95% ДИ: 0,84-0,98); 2-я – ригидностью парасимпатической активности при уменьшении периода максимальной мощности в этом диапазоне (95% ДИ: 1,9-3,3) и отсутствием синхронизации и напряжения регуляторных систем, что указывает на их недостаточность.
|
|
|
Рис. 1 Изменения вегетативной регуляции в ПОСП и ПКСП по сравнению с фоном в младшей возрастной группе больных РС (1 – 1-я группа; 2 – 2-я группа) |
||
Среди больных зрелого возраста (I период) с помощью кластерного анализа динамики вегетативной регуляции при проведении ПОСП по сравнению с фоновыми значениями ВРС были выделены 3 группы с различными изменениями вегетативных показателей, которые характеризовались различной величиной кардиоинтервалов (meanR_R, р=0,034), разным исходным состоянием сегментарных симпатических (max_LF, р=0,001; LF_128, р<0,001; tMax_LF, р=0,006) и парасимпатических (StandDev, р<0,001; PNN50, р=0,003; RMSSD, р<0,001; max_HF, р=0,009; HF_128, р<0,001) механизмов регуляции, что сопровождалось различным напряжением регуляторных систем (i_VegStr, р<0,001), и имели тенденцию к различной ЭФЛ (р=0,095). Различия по тяжести состояния и типу вегетативной реактивности были статистически недостоверными.
В состоянии покоя больные 1-й группы (ЭФЛ – 50%) характеризовались наибольшей активностью парасимпатического (StandDev, р<0,001 и р=0,002 со 2-й и с 3-й группами соответственно; PNN50, р=0,001 и р=0,053; RMSSD, р<0,001 и р=0,005; max_HF, р=0,002 и р=0,053; HF_128, р<0,001) и симпатического звеньев регуляции (max_LF, р=0,014 и р<0,001; LF_128, р=0,039 и р<0,001) при наименьшей степени напряжения регуляторных систем (i_VegStr, р<0,001 и р=0,003).
При переходе в ортостаз отмечалось увеличение парасимпатических (StandDev, RMSSD, max_HF, HF_128, все – р=0,012; PNN50, р=0,017) и симпатических влияний (LF_128, р=0,069) и периода максимальной мощности низкочастотного диапазона (tMax_LF, р=0,013) на фоне повышения степени напряжения механизмов регуляции (i_VegStr, р=0,012) и относительной активности подкоркового симпатического центра (LF_to_HF, р=0,025), что отражало адекватность адаптивно-компенсаторных механизмов.
При возвращении в клиностатическое положение наблюдалось удлинение кардиоинтервалов (meanR_R, р=0,018), не достигавшее исходных значений (р=0,063) и увеличение вагусной активности (StandDev, RMSSD, max_HF, HF_128, все – р=0,018; PNN50, р=0,043) на фоне уменьшения напряжения механизмов регуляции (i_VegStr, р=0,018), периода максимальной мощности высокочастотного диапазона (tMax_HF, р=0,068) и относительной активности подкоркового симпатического центра (LF_to_HF, р=0,091). Увеличение сегментарных симпатических влияний было статистически незначимым, но сопровождалось уменьшением преобладания парасимпатической активности по сравнению с исходным уровнем (PNN50, р=0,046).
В состоянии покоя пациенты 2-й группы (ЭФЛ – 48%) характеризовались наименьшими значениями средней длительности кардиоинтервалов (наибольшая – в 1-й группе, р=0,015), периода максимальной мощности низкочастотного диапазона (наибольшее – в 3-й группе, р=0,020) и активности сегментарного симпатического и парасимпатического звеньев регуляции при наибольшей степени напряжения регуляторных систем (р=0,071 с 3-й группой).
При переходе в ортостатическое положение наблюдалось повышение активности сегментарных симпатических механизмов (max_LF, р=0,035; LF_128, р=0,009; LF_to_HF, р<0,001) на фоне уменьшения парасимпатических влияний (PNN50, р=0,001; max_HF, р=0,011; HF_128, р=0,033) и напряжения регуляторных систем (i_VegStr, р=0,054). При этом отмечалось повышение степени синхронизации процессов регуляции (K1_AKF, р<0,001), что сопровождалось усилением автономной регуляции (StandDev, р=0,001) и увеличением периода максимальной мощности высокочастотного диапазона (tMax_HF, р=0,023).
Вследствие этого в ПОСП 2-я группа отличалась наименьшими средней длительностью кардиоинтервалов (meanR_R, р=0,051) и активностью вагальных влияний по сравнению с 1-й и 3-й группами (PNN50, р=0,036 и р=0,008; RMSSD, р=0,045 и р=0,002; HF_128, р=0,015 и р=0,003 соответственно; max_HF, р=0,014 с 3-й группой), что сочеталось с наибольшими степенью синхронизации (K1_AKF, р=0,013 и р=0,001) и напряжения регуляторных систем (наименьшая – в 1-й группе, р=0,045), а также – относительной активностью подкорковых симпатических центров (LF_to_HF, р=0,003). Адаптивно-компенсаторные процессы в этой группе обеспечиваются, вероятно, сохранностью барорецепторных механизмов и максимальным напряжением центральных уровней регуляции.
При возвращении в клиностатическое положение наблюдалось удлинение кардиоинтервалов (meanR_R, р<0,001) до исходного уровня, усиление сегментарных симпатических (max_LF, р=0,099; LF_128, р=0,046) и парасимпатических влияний (StandDev, PNN50, RMSSD, max_HF, HF_128, все – р<0,001), уменьшение степени напряжения и синхронизации механизмов регуляции (i_VegStr, K1_AKF, оба – р<0,001), периода максимальной мощности высокочастотного диапазона (tMax_HF, р=0,052) и относительной активности подкоркового симпатического центра (LF_to_HF, р<0,001).
При этом уровень активности парасимпатических и симпатических образований превысил соответствующие показатели исходного состояния (StandDev, HF_128, max_LF, все – р<0,001; PNN50, RMSSD, LF_128, все – р=0,001; max_HF, р=0,003), напряжение регуляторных систем оказалось ниже фонового (i_VegStr, р<0,001), а степень синхронизации механизмов регуляции оставалась повышенной (K1_AKF, р=0,054).
3-ю группу составили больные с отсутствием лечебного эффекта (р=0,048 по сравнению с 1-й группой и р=0,037 – со 2-й). По сравнению с пациентами 2-й группы больные 3-й группы характеризовались тенденцией к менее выраженным вагальной недостаточности (StandDev, р=0,080) и напряжению регуляторных механизмов (i_VegStr, р=0,071), однако период максимальной мощности в низкочастотном диапазоне у них был значительно больше (tMax_LF, р=0,020), что отражает включение более высоких уровней регуляции.
При переходе в ортостатическое положение у пациентов этой группы наблюдалось повышение активности сегментарных симпатических (max_LF, р=0,028) и парасимпатических (PNN50, р=0,043; HF_128, р=0,028) регуляторных механизмов при снижении степени синхронизации процессов регуляции (K1_AKF, р=0,028), что в целом может указывать на недостаточность управления вегетативными механизмами.
В ПОСП данная группа характеризовалась самыми низкими степенью синхронизации регуляторных механизмов (K1_AKF, р<0,001) и относительной активностью подкорковых симпатических структур (LF_to_HF, р=0,001 со 2-й и р=0,053 с 1-й группами) на фоне наибольшей активности вагусных влияний (PNN50, р=0,009; RMSSD, р=0,003; max_HF, р=0,054; HF_128, р=0,002), что отражает истощение как центрального, так и автономного контуров регуляции.
При возвращении в клиностатическое положение наблюдалось удлинение кардиоинтервалов (meanR_R, р=0,046) до исходного уровня и увеличение степени синхронизации регуляторных механизмов (K1_AKF, р=0,075). Увеличение сегментарных симпатических влияний было статистически незначимым, а парасимпатических – нерезко выраженным по сравнению с исходными значениями (StandDev, р=0,046; HF_128, р=0,028). Степень напряжения механизмов регуляции уменьшалась (i_VegStr, р=0,046 с фоном).
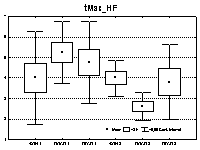
Таким образом, в средней возрастной группе в ПОСП наблюдалось (рис. 2) сглаживание различий между тремя группами в уровне барорецепторной активности и уменьшение – в уровне вагусной (за счет 2-й группы, имевшей, вероятно, относительную недостаточность этих звеньев регуляции), однако у больных с самой низкой ЭФЛ выявились и самые низкие значения относительной активности подкорковых симпатических центров (95% ДИ: 0,7-1,7 ед.) и степени синхронизации регуляторных систем (95% ДИ: –0,1-0,6 ед.), что характеризует истощение адаптивно-компенсаторных механизмов.
|
|
|
Рис. 2 Изменения вегетативной регуляции в ПОСП и ПКСП по сравнению с фоном у больных РС зрелого возраста (I период) (1 – 1-я группа; 2 – 2-я группа; 3 – 3-я группа) |
||
В ПКСП состояние вегетативной регуляции у больных 1-й группы практически возвращалось к исходным значениям, отличаясь более высокой вагусной активностью (StandDev, р=0,015; PNN50, р=0,021; RMSSD, р=0,013; max_HF, р=0,053; HF_128, р=0,016) и низким напряжением регуляторных систем (i_VegStr, р=0,017) по сравнению с остальными пациентами. 2-я группа характеризовалась самой низкой величиной кардиоинтервалов (meanR_R, р=0,043), 3-я – наиболее выраженной барорецепторной недостаточностью (LF_128, р=0,046 с 1-й группой). Парасимпатические влияния увеличивались в обеих этих группах недостаточно и оставались значительно более низкими по сравнению с 1-й группой с высокой статистической значимостью.
В группе больных зрелого возраста (II период) результаты кластерного анализа динамики вегетативной регуляции при проведении ПОСП по сравнению с фоновыми значениями ВРС не показали статистически достоверных различий ЭФЛ между разными кластерами, что указывает на большее влияние других параметров.
В этой группе с лечебным эффектом коррелировала низкая величина кардиоинтервалов (meanR_R, r=0,30; р=0,049) и высокая степень централизации регуляции сердечного ритма в пробе с ГМД (K1_AKF, r=0,31; р=0,037). При помощи кластерного анализа по этим показателям были выделены 2 группы с различным состоянием вегетативной регуляции и с различной ЭФЛ (р=0,037). Кроме того, 2-я группа, имевшая лучший эффект лечения, отличалась и более высокой частотой обострений по сравнению с 1-й (2,1±1,1 и 1,2±0,9; р=0,004).
1-я группа характеризовалась б?льшими величиной кардиоинтервалов (meanR_R, р<0,001), активностью сегментарных симпатических (max_LF, р=0,031) и парасимпатических (StandDev, р=0,054; PNN50, р=0,060; RMSSD, р=0,043; HF_128, р=0,069) механизмов по сравнению со 2-й группой больных, что сочеталось с меньшей степенью напряжения систем регуляции (i_VegStr, р=0,029). В целом это может указывать на нарушение согласованности сегментарных и центральных регуляторных механизмов вследствие слабости последних.
В ПОСП в обеих группах наблюдалось уменьшение величины кардиоинтервалов (meanR_R, обе группы – р<0,001) на фоне возрастания степени централизации регуляторных механизмов (K1_AKF, р<0,001 и р=0,002). Вагусная активность снижалась (в 1-й группе – PNN50, р=0,031; RMSSD, р=0,020; max_HF, р=0,020; HF_128, р=0,049; во 2-й – RMSSD, р=0,049), однако во 2-й группе спектральные характеристики парасимпатической регуляции оставались неизменными (за счет больных с положительной ЭФЛ), что обусловило относительное усиление превалирования вагусных влияний (StandDev, р=0,024 и р=0,020). Отмечалось более значимое уменьшение периода максимальной мощности высокочастотного диапазона во 2-й группе (tMax_HF, р=0,016), главным образом, за счет больных с неэффективным лечением (р=0,021), на фоне одинакового уменьшения периода максимальной мощности в низкочастотном диапазоне (tMax_LF, р=0,021 и р=0,020). При этом в 1-й группе более значимо повышалась относительная активность подкоркового симпатического центра (LF_to_HF, р=0,004 и р=0,066).
В результате этих изменений в ортостазе сглаживались различия между группами в состоянии сегментарных симпатических и парасимпатических образований при сохранении относительного преобладания вагусных влияний (meanR_R, р<0,001; StandDev, р=0,056) в 1-й группе и напряжения регуляторных механизмов – во 2-й (i_VegStr, р=0,003).
В 1-й группе при переходе в ортостаз отмечалось более значимое повышение степени синхронизации регуляторных механизмов (K1_AKF, р<0,001), чем у больных 2-й группы, имевших положительный эффект лечения (K1_AKF, р=0,012). Вместе с тем непосредственно по результатам проб во 2-й группе различия между пациентами с разной ЭФЛ были выявлены лишь в пробе с ГМД: больные с положительным лечебным эффектом характеризовались более высокой степенью синхронизации регуляции сердечного ритма по сравнению с пациентами с неэффективным лечением (K1_AKF 0,74±0,31 и 0,57±0,37; р=0,046).
Такие же различия в пробе с ГМД выявились и между пациентами 1-й группы и больными 2-й группы с положительной ЭФЛ (K1_AKF, р=0,056). Исходно и в ПОСП эти две группы различались только по величине кардиоинтервалов (meanR_R, р<0,001 и р=0,007), однако в ПКСП выявились различия, характерные для исходного уровня 1-й и 2-й групп в целом.
При возвращении в клиностатическое положение в обеих группах продолжалось уменьшение напряжения регуляторных механизмов (i_VegStr, с состоянием покоя – р=0,001 и р=0,002; с ортостазом – р=0,016 и р=0,013) при сохранении различий между группами (в ортостазе – р=0,003; в клиностазе – р=0,002). При этом у пациентов с положительным эффектом лечения это снижение было статистически незначимым (как в ортостазе, так и в клиностазе), а у больных с отсутствием лечебного эффекта – значительным в ПОСП (р=0,028) и в ПКСП (р=0,009), что может отражать истощение регуляторных механизмов с нарушением адаптивно-компенсаторных возможностей вегетативной регуляции в группе больных с недостаточной ЭФЛ.
Об этом же свидетельствует и увеличение активности сегментарных симпатических и парасимпатических механизмов в сравнении с ПОСП (1-я группа: PNN50, р=0,025; RMSSD, р=0,002; max_HF, р=0,002; HF_128, р=0,002; max_LF, р=0,085; LF_128, р=0,012; 2-я: RMSSD, р=0,063; max_LF, р=0,049; LF_128, р=0,022) и с исходным состоянием (1-я группа: RMSSD, р=0,031; HF_128, р=0,008; max_LF, р=0,006; LF_128, р=0,008; 2-я: RMSSD, р=0,097; max_LF, р=0,006; LF_128, р=0,004) на фоне уменьшения периода максимальной мощности в высокочастотном диапазоне у пациентов 2-й группы (tMax_HF, р=0,032) при неизменной активности сегментарных симпатических и парасимпатических механизмов у больных с положительным лечебным эффектом как в ПОСП, так и в ПКСП. По данным спектрального анализа активность парасимпатического звена и в целом во 2-й группе не изменялась, что у больных с отсутствием положительного лечебного эффекта сопровождалось увеличением периода максимальной мощности высокочастотного диапазона (tMax_HF, р=0,021 и р=0,062 с фоном соответственно).
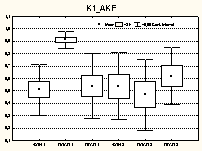
Таким образом, в старшей возрастной группе в ПОСП наблюдалось (рис. 3) сглаживание исходных различий в состоянии сегментарного уровня регуляции между двумя группами за счет снижения парасимпатической активности и отсутствия барорецепторной реакции в группе с меньшей ЭФЛ. В ПКСП данные различия выявлялись вновь за счет значительного повышения вагусных влияний и недостаточного – барорецепторных у больных с меньшей ЭФЛ. Положительный эффект лечения сочетался с отсутствием изменений вагусной активности и периода максимальной мощности в этом диапазоне по данным спектрального анализа в обоих состояниях.
|
|
|
Рис. 3 Изменения вегетативной регуляции в ПОСП и ПКСП по сравнению с фоном у больных РС зрелого возраста (II период) (1 – 1-я группа; 2 – 2-я группа) |
||
Выводы
Исходные данные показателей ВРС представлены и находятся в редакции.
Литература
1. Акимов Г.А., Ерохина Л.Г., Стыкан О.А. Неврология синкопальных состояний. – М.: Медицина, 1987. – 208 с.
2. Воробйов К.П. Моніторна система для інтенсивної терапії ГБО: Сертифікат якості, МОЗ України. – 01.08.1995. 3. Воробьев К.П., Сорокин Ю.Н. Зависимость характеристик вариабельности ритма сердца при рассеянном склерозе от возраста, половой принадлежности и тяжести состояния // Укр. мед. часопис. – 2006. – № 2. – С. 89-94.
4. Паламарчук Є.А., Воробйов К.П. Верифікація механізму обрахунку спектральних характеристик варіабельності серцевого ритму в діагностичних системах за допомогою програмного еталону гармонічних сигналів // Клин. информатика и телемедицина. – 2004. – № 1. – С. 41-46.
5. Тайцлін В.Й., Волошина Н.П., Негреба Т.В. и др. Вегетативна дистонія і нейрофізіологічні показники до і після лікування хворих з розсіяним склерозом // Мат. Міжнар. науково-практ. конф. "Проблеми клінічної неврології: історія, сучасність, перспективи". – Львів. – 2005. – С. 114-115.
6. Gunal D.I., Afsar N., Tanridag T., Aktan S. Autonomic Dysfunction in Multiple Sclerosis: Correlation with Disease-Related Parameters // Eur. Neurol. – 2002. – V. 48. – Р. 1-5.
7. Flachenecker P. Autonomic dysfunction in Guillain-Barre syndrome and multiple sclerosis // J. Neurol. – 2007. – V. 254, № 5, Suppl. 2. – Р. II96-II101.
8. Mahovic D, Lakusic N. Progressive impairment of autonomic control of heart rate in patients with multiple sclerosis // Arch. Med. Res. – 2007. – V. 38(3). – Р. 322-325.
9. Saaria A., Tolonenb U., Paakkoc E. et al. Cardiovascular autonomic dysfunction correlates with brain MRI lesion load in MS // Clin. neurophysiology. – 2004. – V. 115, № 6. – P. 1473-1478.
10. de Seze J., Stojkovic T., Gauvrit J.Y. et al. Autonomic dysfunction in multiple sclerosis: cervical spinal cord atrophy correlates // J. Neurol. – 2001. – V. 248(4). – Р. 297-303.